中外製薬株式会社(本社:東京都中央区日本橋)は、改変型抗PD-L1ヒト化モノクローナル抗体「テセントリク®点滴静注(一般名:アテゾリズマブ/遺伝子組換え)」について、転移性または切除不能な局所進行乳がんに対し、効能・効果の追加と、用法・用量の追加、及び840mg製剤の剤形追加の承認申請を、2018年12月21日に厚生労働省に行ったと発表しました。
「テセントリク®点滴静注(TECENTRIQ®)」は、2018年1月に「切除不能な進行・再発の非小細胞肺癌(NSCLC)」を効能・効果として承認を取得し、2018年4月に発売を開始しました。
また、2018年12月に一次治療の「進展型小細胞肺がん(Extensive-SCLC)」に対する適応拡大を申請しています。
日本人女性に於ける乳がんの年間罹患者数は、8万6,500人(2018年予測値)、また死亡者数は1万4,285人(2017年予測値)と推計されています。
〔2018 国立研究開発法人国立がん研究センターがん対策情報センター・がん統計2018年のがん統計予測:2018年09月15日付より〕
乳がんは、がん細胞の性質によって、薬剤の反応性や増殖する力の強さなどが異なります。
乳がん細胞を、性質を示す“サブタイプ”と呼ばれる指標(ホルモン感受性・HER2過剰発現・がん細胞の増殖能力=Ki-67)によって5種類に分類したものを、サブタイプ分類と称し、薬物療法は、これらのサブタイプに応じて適切な治療が選択されます。
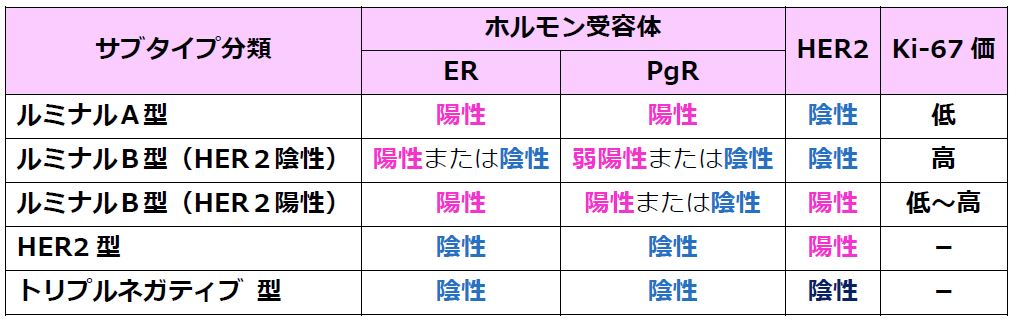
〔中外製薬株式会社 ニュースリリース2018年12月21日より〕
〔日本乳癌学会 編. 患者さんのための乳がん診療ガイドライン 2016年版. 金原出版, p126, 2016.〕
〔日本乳癌学会 編. 乳癌診療ガイドライン ②疫学・診断編 2018年版. 金原出版, p240, 2018.〕
〔MSD株式会社・MSD製薬/乳がんのサブタイプ分類より〕
トリプルネガティブ乳がん(TNBC=Triple-negative breast cancer)の特徴として、他のタイプの乳がんに比べ、50歳未満(閉経前)の女性に多い事が特徴です。
また、トリプルネガティブ乳がんは、ホルモン受容体(エストロゲン受容体(ER=卵胞ホルモン)、及びプロゲステロン受容体(PgR=黄体ホルモン))の発現や、ヒト上皮成長因子受容体-2(HER2)の過剰発現を伴わない悪性腫瘍と定義され、他のタイプの乳がんに比べ、一般的に増殖能が高く(進行が早い)、化学療法の効果も低く、特に予後不良とされ、生存期間が短くなると言われています。
◆ホルモン受容体(HR)陽性のみは乳癌全体の70-80%
◆HER2過剰発現のみの乳癌は20-25%
◆ホルモン受容体陽性+HER2過剰発現10-15%
◆トリプルネガティブ乳癌は15%程度
〔国立研究開発法人国立がん研究センターがん対策情報センター 用語集:トリプルネガティブ乳がん〕
〔一般社団法人日本乳癌学会 Q27. 病理検査でどのようなことがわかりますか。〕
〔中外製薬株式会社 ニュースリリース2018年12月21日より〕
トリプルネガティブ乳がんは、全ての乳がんの約15%を占めると推計され、最初から化学療法が行われますが、治療抵抗性が発現しやすく、治療法が限られており、やがて病勢進行に至ります。
トリプルネガティブ乳がんの手術前後(周術期)に於ける標準治療は、抗癌性抗生物質のアントラサイクリン(又はアンスラサイクリン)系薬剤と、微小管阻害薬のタキサン系薬剤(タキソール、アブラキサン等)となっていますが、抗PD-1抗体や抗PD-L1抗体の免疫チェックポイント阻害剤で、乳癌の適応承認を得た薬剤はありませんでした。
今回の「テセントリク®点滴静注」の適応拡大申請は、国際共同第III相臨床試験の成績に基づいています。
国際共同第III相臨床試験は、全身薬物療法を受けていない『切除不能な局所進行または転移性トリプルネガティブ乳がん』の患者を対象に、テセントリクとアブラキサン(アルブミン懸濁型)の併用と、アブラキサン(アルブミン懸濁型)単独を比較したものです。

「テセントリク®(Tecentriq®)点滴静注(一般名:アテゾリズマブ=atezolizumab)」は、腫瘍細胞に発現するPD-L1(Programmed Death Ligand-1)タンパク質と結合し、T細胞の表面上に見られるPD-1(programmed death 1)と腫瘍細胞の結合を阻止します。
この阻止によって、腫瘍細胞のコントロールから逃れたT細胞が活性化され、腫瘍細胞を効率的に検出し攻撃します。
スイス・ロシュ社の2018年7月2日発表の中間解析で、PD-L1の発現が認められる患者に於いて、併用群で全生存期間(OS)改善の兆候が認められた。
更に2018年10月22日の発表で、テセントリクとアブラキサン(アルブミン懸濁型)の併用はITT(Intent to treat=治療意図)解析集団、及びPD-L1の発現が認められる乳がん患者の両集団で、統計学的に有意な病勢進行の低下、及び死亡リスクの低下を示した。
また、PD-L1の発現が認められる患者に於いて、臨床的に意義のある全生存期間の延長も示しましたが、PD-L1発現の無い患者では有意差は認められなかったとしている。



