厚生労働省の薬事・食品衛生審議会 医薬品第一部会は3月1日、生化学工業株式会社(本社:東京都千代田区丸の内)から、2014年(平成26)1月30日に、製造販売承認申請が出されていた、“保存療法で十分な改善が得られない「後縦靭帯(こうじゅうじんたい)下脱出型の腰椎椎間板ヘルニア」”を効能・効果とする、「ヘルニコア椎間板注用1.25単位(一般名:コンドリアーゼ/開発コード:SI-6603)」の国内に於ける製造販売承認を了承した。
腰椎椎間板ヘルニアは、腰部の神経が通っている5個の腰椎と言う脊柱管の骨の部分を指し、腰骨の間のクッション材である「椎間板」が変形して飛び出し、神経を圧迫する病態を指します。
しかし、画像診断でヘルニアが確認されたとしても、それが即、症状に結びつくとは限らず、長い間無症状のまま、ヘルニア塊が自然消滅、或いは縮小するケースも少なくありません。
腰痛のうち、85%は原因不明だと言われ、残り15%のうち、椎間板ヘルニアが原因であると特定出来るのは僅か5%程度に過ぎないと言われています。〔沢井製薬/椎間板ヘルニアの原因と症状より〕
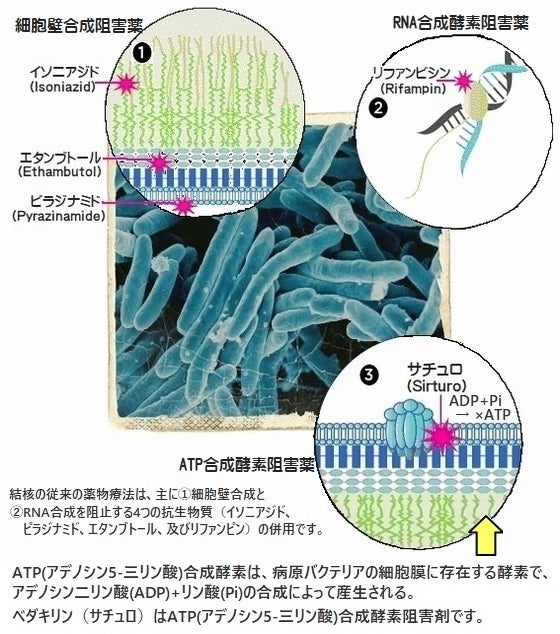
腰椎椎間板ヘルニアの病態診断は、『神経学的検査』と『画像検査』により、【膨隆・突出型】【後縦靭帯下脱出型】【経後縦靭帯(突破)脱出型】【遊離脱出型】の四つに分類されますが、本剤は、このうち後縦靭帯下脱出型のみに使える。
腰椎椎間板ヘルニアは、時間経過に伴い症状が軽減する事も多いため、治療の原則は保存療法となり、保存療法にはNSAIDs(非ステロイド系消炎鎮痛薬=non─steroidal anti─inflammatory drugs)などの鎮痛薬の投与、ステロイド又は局所麻酔薬を用いた神経ブロック、理学療法が主に行われる。
現在、腰椎椎間板ヘルニアの根本治療となる薬物療法が存在しない事から、これらの保存療法で効果不十分な重度の場合は、ヘルニアを取り除くための手術を受けていますが、これには高額の費用負担に加え、数週間の入院とリハビリが必要です。
「ヘルニコア椎間板注用1.25単位」は、1回の投与で手術と同程度の症状改善効果が期待できる薬剤であり、患者の身体的負荷の軽減に貢献が期待されます。
【腰椎椎間板ヘルニア治療剤「ヘルニコア椎間板注用1.25単位(SI-6603)」について】
腰椎椎間板ヘルニアは、椎間板の中心部分にある髄核や外側の線維輪の一部が突出する事で、脊椎周辺の神経を圧迫し、痛みやしびれを引き起こす疾患です。
本薬剤は、髄核の構成成分であるグリコサミノグリカン(*GAG)を特異的に分解するコンドリアーゼ(Condoliase)という酵素を利用した注射薬であり、椎間板内に直接投与する事により、GAGを分解して髄核を縮小させる事で、神経への圧迫を減少させる効果が期待されます。
また、タンパク質を分解しないため、血管や神経などの周辺組織に影響を与えないと考えられています。
*グリコサミノグリカン(GAG):複合糖質の主要成分の1つ。コンドロイチン硫酸やヒアルロン酸等。
本剤は、米国でも第Ⅲ相臨床試験が行われたが、主要評価項目の投与後13週での下肢痛軽減で、統計学的に有意な改善効果が認められず、米国食品医薬品局(FDA)など海外で承認された国はない。
このため生化学工業株式会社と、フェリング・ファーマシューティカルズ社は2018年2月19日、前回実施の無作為化二重盲検プラセボ対照並行群間比較試験結果から得られた知見を反映させた、米国における第Ⅲ相臨床試験(追加試験)を開始したと発表しました。
追加の第Ⅲ相臨床試験では、本剤の効果が具現しやすい症例の振るい分けなどが行われ、体格の大きい米国人に、より治療効果の高い投与量などを確認してゆく。
この点について厚生労働省の担当官は、「(日本での部会通過は)米国での試験結果も検討した上での最終的な評価。日本人での試験結果を重く見て、(部会では)承認して差し支えないと言うことになった」と説明した。