November 14, 2017, 3:26 am
↧
November 22, 2017, 2:47 am
厚生労働省の中央社会保険医療協議会 総会は11月15日、新薬12製品(12成分25品目)を薬価収載する事を決め、11月22日に収載された。これで保険適応薬となる。
この決定によって、新薬12製品の薬価が明示された。■ ファイザー株式会社(本社:東京都渋谷区代々木)「手術不能または再発乳がん治療薬:サイクリン依存性キナーゼ(CDK)4/6阻害薬「イブランス®カプセル25mg、同カプセル125mg」
(HR+HER2-=ホルモン受容体陽性ヒト上皮増殖因子受容体2陰性の進行性又は転移性再発乳がん)薬価:25mg/1カプセル 5576.40円、125mg/1カプセル 2万2560.30円(原価計算方式)■ グラクソ・スミスクライン株式会社(本社:東京都渋谷区千駄ヶ谷)「既存治療で効果不十分な全身性エリテマトーデス:可溶性Bリンパ球刺激因子(BLyS)抗体薬ベンリスタ点滴静注用120mg、同400mg、同皮下注200mgオートインジェクター、同皮下注200mgシリンジ(一般名:ベリムマブ)」薬価:120mg/1瓶 1万5404円、400mg/1瓶 5万245円、200mg/1mL/1キット 2万4547円、200mg/1mL/1筒 2万4540円(原価計算方式)■ ファイザー株式会社(本社:東京都渋谷区代々木)「肺動脈性肺高血圧症治療薬:ホスホジエステラーゼ5(PDE5)阻害薬「レバチオ®錠20mg」(一般名:シルデナフィルクエン酸塩)及び「レバチオ®懸濁用ドライシロップ900mg」「レバチオ®ODフィルム20mg」薬価:20mg1錠 1213.50円、10mg1mL(懸濁後の内用液として)671.30円(1日薬価:4027.80円)■ アッヴィ合同会社(本社:東京都港区三田)「C型慢性肝炎またはC型代償性肝硬変におけるウイルス血症の改善:NS3/4Aプロテアーゼ阻害薬(グレカプレビル水和物)+NS5A阻害薬(ピブレンタスビル)マヴィレット配合錠」
ジェノタイプ1~6の全てのジェノタイプを対象とした、初のC型肝炎抗ウイルス剤でC型慢性肝炎、C型代償性肝硬変治療薬薬価:1錠 2万4210.40円(1日薬価:7万2631.20円)■ SBIファーマ株式会社(本社:東京都港区六本木)「経尿道的膀胱腫瘍切除時における筋層非浸潤性膀胱がんの可視化」(手術開始前使用)
アラグリオ顆粒剤分包1.5g(一般名:アミノレブリン酸塩酸塩)薬価:1.5g/1包 7万4873.70円■ サノフィ株式会社(本社:東京都新宿区西新宿)「既存治療で効果不十分な関節リウマチ治療剤:完全ヒト型抗IL-6 受容体モノクローナル抗体ケブザラ皮下注150mgシリンジ、同皮下注200mgシリンジ(一般名:サリルマブ)」薬価:150mg1.14mL/1筒 4万5467円、200mg1.14mL/1筒 6万329円(1日薬価:4309円)■ ヤンセンファーマ株式会社(本社:東京都千代田区西神田)「再発又は難治性の多発性骨髄腫治療薬:CD38モノクローナル抗体ダラザレックス点滴静注100mg、同400mg(一般名:ダラツムマブ)」薬価:100mg/5mL/1瓶 5万1312円、400mg/20mL/1瓶 18万4552円(1日薬価:2万53円)■ メルクセローノ株式会社(本社:東京都目黒区下目黒)「根治切除不能なメルケル細胞がん治療薬:ヒト型抗PD-L1抗体バベンチオ点滴静注200mg(一般名:アベルマブ)」薬価:200mg/10mL/1瓶 21万8955円(1日薬価:3万9099円)■ MSD株式会社(本社:東京都千代田区九段北)「クロストリジウム・ディフィシル感染症の再発抑制:ジーンプラバ点滴静注625mg(一般名:ベズロトクスマブ)」薬価:625mg/25mL/1瓶 33万500円(原価計算方式)■ EAファーマ株式会社(本社:東京都中央区入船)「潰瘍性大腸炎(重症を除く)泡状注腸製剤:レクタブル2mg注腸フォーム14回(一般名:ブデソニド)」薬価:48mg/30.8g/1瓶 6940.60円(原価計算方式)■ 帝國製薬株式会社(本社:香川県東かがわ市三本松)「アレルギー性鼻炎、蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒:ルパフィン錠10mg(一般名:ルパタジンフマル酸塩)薬価:10mg1錠 69.40円■ CSLベーリング株式会社(本社:東京都江東区東雲)「血液凝固第8因子欠乏患者における出血傾向の抑制:エイフスチラ静注用250IU、同500IU、同1000IU、同1500IU、同2000IU、同2500IU、同3000IU(一般名:ロノクトコグアルファ)薬価:
250国際単位1瓶(溶解液付) 2万2308円
500国際単位1瓶(溶解液付) 4万1370円
1000国際単位1瓶(溶解液付) 7万6719円
1500国際単位1瓶(溶解液付) 11万104円
2000国際単位1瓶(溶解液付) 14万2273円
2500国際単位1瓶(溶解液付) 17万3568円
3000国際単位1瓶(溶解液付) 20万4184円(1日薬価:7万2923円)この中では、ピーク時売上を224億円(5年後)と設定された、ファイザーの乳がん治療薬として、世界初(国内初)の経口サイクリン依存キナーゼ(CDK)4/6阻害薬「イブランスカプセル」や、アッヴィ合同会社の『全てのジェノタイプのC型肝炎』を適応とする「マヴィレット配合錠」はピーク時売上を377億円(2年後)と予測した。
また、メルクセローノのメルケル細胞がん治療薬で、国内初の抗PD-L1抗体「バベンチオ点滴静注」も今回、収載される事となった。
↧
↧
November 26, 2017, 5:48 am
厚生労働省の薬事・食品衛生審議会 医薬品第二部会は11月6日、中外製薬株式会社(本社:東京都中央区日本橋)が国内承認申請していた、「切除不能な進行・再発の非小細胞肺癌」に対する改変型抗PD-L1モノクローナル抗体「テセントリク®点滴静注1200mg(一般名:アテゾリズマブ「遺伝子組換え」)」について、新有効成分含有医薬品として承認申請を了承した。
「テセントリク®(TECENTRIQ®)点滴静注1200mg」は、非小細胞肺がん(NSCLC)に対する免疫チェックポイント阻害剤で、国内初の抗PD-L1モノクローナル抗体である。
本剤は、メルケル細胞がんを適応症として承認された「バベンチオ®点滴静注200mg」に次ぐ製品であり、非小細胞肺がんの適応を持つ初の抗PD-L1抗体薬となります。
早ければ、約1ヶ月ほどで正式承認される。再審査期間は8年。最適使用推進ガイドラインの対象品目である。![テセントリク点滴静注_TECENTRIQ]() 切除不能な進行・再発の非小細胞肺がんの適応を持つ初の抗PD-L1抗体薬
切除不能な進行・再発の非小細胞肺がんの適応を持つ初の抗PD-L1抗体薬
「テセントリク®(Tecentriq®)点滴静注1200mg(一般名:アテゾリズマブ」
日本では、2015年の肺がんの予測年間罹患者数は約13万4,000人(男性9万1,000人、女性4万3,000人)と推計されています。
また、国内の年間死亡者数は約7万7,000人(男性5万5,000人、女性2万2,000人、2015年予測値)であり、癌にともなう死亡原因の第1位となっています(国立がん研究センターがん対策情報センター.2015年のがん統計予測)。非小細胞肺がんでは、喫煙が特徴的な危険因子である事がよく知られていますが、非喫煙者や、近年では女性の肺がんも増加の一途をたどっています。
◆非小細胞肺がんリスク因子◆
(1)喫煙、(2)受動喫煙、(3)ラドン、(4)石綿(アスベスト)、(5*)大気汚染、(6)職業性の粉塵曝露、(7)後天性の肺疾患、(8)非喫煙女性に生じる肺がんに関連している事が疑われている室内の空気汚染(木炭ストーブ、調理にともなう蒸気)、(9)食事習慣、(10)遺伝的感受性
(11)タバコを喫わない女性に、エストロゲンの影響が大きい傾向が見られる事。
(5*)大気汚染とは‥‥空気中の様々な有害物質(細菌やウイルス因子、自動車の排気ガス、工場の煤煙、ホコリやチリなど)![肺がんの危険因子]() 肺がんの危険因子。
肺がんの危険因子。
▼ESMO(欧州臨床腫瘍学会:スイス)非小細胞肺癌:患者の手引き
http://www.jsco.or.jp/guide/user_data/upload/File/nonsmallcell.pdf
▼ベルギー癌克服基金2017:Anticancer Fund Org
▼日本癌治療学会
▼国立がん研究センター研究所などによる遺伝子解析
▼オムロンヘルスケア「タバコを喫わないのに肺がん。なぜ?」
http://www.healthcare.omron.co.jp/resource/column/life/100.html
「テセントリク®点滴静注1200mg(一般名:アテゾリズマブ=atezolizumab)」は、腫瘍細胞(Target Cell)、又は腫瘍浸潤免疫細胞(Immune Cell)に発現するPD-L1(Programmed Death Ligand-1)と呼ばれるタンパク質を標的としたモノクローナル抗体です。
PD-L1は、T細胞の表面上に見られる“PD-1(programmed death 1)”、“B7.1(T細胞活性化共刺激分子)”の双方と結合し、T細胞の働きを阻害します。
「テセントリク®点滴静注1200mg」は、この結合を阻害する事により免疫細胞であるT細胞が活性化され、腫瘍細胞を効率的に検出し攻撃します。
「「テセントリク®点滴静注1200mg(海外販売名:Tecentriq®)」は、米国食品医薬品局(FDA)が承認したPD-L1を標的とする免疫チェックポイント阻害剤で、2016年5月、『局所進行または転移性尿路上皮癌の二次治療』、2016年10月、『白金製剤ベースの化学療法施行中、又は施行後に病勢が進行した転移性非小細胞肺癌』に対する承認を取得している。
また、2017年1月にシスプラチン(製品名:ブリプラチン/ランダ)による化学療法が不適格な局所進行または転移性尿路上皮癌の一次治療に対し、優先審査品目に指定されています。
正式承認されれば、非小細胞肺がん(NSCLC)の適応を持つ初の抗PD-L1抗体となる。海外では2017年7月時点で、NSCLCに関する効能・効果で13の国・地域で承認済。
↧
December 4, 2017, 2:44 am
↧
December 10, 2017, 7:47 am
↧
↧
December 16, 2017, 7:58 am
アレクシオンファーマ合同会社(本社:東京都渋谷区恵比寿)が2017年3月23日に効能追加申請した、「全身型重症筋無力症(難治性=免疫グロブリン大量静注療法又は血液浄化療法による症状の管理が困難な場合に限る)」を効能・効果とする、抗補体モノクローナル抗体製剤「ソリリス®点滴静注300mg(一般名:エクリズマブ=遺伝子組換え)」について、厚生労働省の薬事・食品衛生審議会 医薬品第一部会は12月4日、新効能・新用量医薬品として承認申請を了承した。
本剤は希少疾病用医薬品であり、再審査期間は10年となる。![ソリリス点滴静注300mg]() 抗アセチルコリン受容体(AChR)抗体陽性の難治性全身型重症筋無力症治療薬
抗アセチルコリン受容体(AChR)抗体陽性の難治性全身型重症筋無力症治療薬
抗補体モノクローナル抗体「ソリリス®点滴静注300mg(一般名:エクリズマブ)」
更に重症化して、頭部、頸部、体幹、四肢および呼吸筋の筋力低下から麻痺を起こし、呼吸困難を来す事もあります。
眼の症状だけの場合は『眼筋型』、全身の症状がある場合を『全身型』と呼んでいます。
全身型は、難治性の全身型重症筋無力症(gMG=generalized Myasthenia Gravis)として知られ、全身型重症筋無力症の患者の大半の症状は、既存の治療法でコントロール出来ますが、10~15%の患者では、これら治療法では十分な効果が得られない難治性となります。
重症筋無力症の分類![重症筋無力症の分類]()
難治性の全身型重症筋無力症では、既存の治療法を尽くしても、全身の著しい筋力低下が続き、その結果として、不明瞭な会話、嚥下障害(飲み込みが困難である)、むせ(咳込む)、複視、日常生活に支障を来すほどの疲労感、呼吸筋の筋力低下による息切れを示し、頻繁な通院と、呼吸不全の治療期間も含めたICU治療や長期入院が必要となります。
重症筋無力症は、厚生労働省が指定する難病(特定疾患)の一つで、患者数は1988年で5,989人、2006年には15,100人、現在は20,000人以上と推定されています。難治性の全身型重症筋無力症は、抗アセチルコリン受容体(AChR)抗体陽性の稀な自己免疫疾患で、補体系(免疫システム血清タンパク質)により神経筋接合部に進行性の炎症をきたし破壊され、その結果、神経筋伝達障害が引き起こされ、筋肉が正常に機能しなくなります。
時に、呼吸器系の深刻な症状に直面し、重症化して生命を脅かす事もあります。
![全身性重症筋無力症発症の神経筋接合部のアセチルコリン受容体抗体]() 神経筋接合部にある神経からの命令を伝えるアセチルコリン受容体が、
神経筋接合部にある神経からの命令を伝えるアセチルコリン受容体が、
抗アセチルコリン受容体抗体が作られる事で、アセチルコリン受容体の働きが減少し発症。
これまで、抗アセチルコリン受容体(AChR)抗体陽性の難治性の全身型重症筋無力症(gMG)に対して、承認された治療法はありませんでした。
全身型重症筋無力症(gMG)では、ヒト補体であるC5転換酵素がC5と結合し、C5a及びC5bの産生を促進させ、c5b-9(膜侵襲複合体、又は終末補体複合体)によって神経筋伝達の欠損を引き起こしていました。
「ソリリス®点滴静注300mg」は、アレクシオンファーマ合同会社が創製したファースト・イン・クラス(画期的医薬品)の終末補体阻害剤です。
![ソリリス点滴静注300mg作用機序]() ソリリス®(エクリズマブ)点滴静注300mgの作用機序
ソリリス®(エクリズマブ)点滴静注300mgの作用機序
ヒト補体であるC5に対して高い親和性を有するヒト化モノクローナル抗体で、C5の活性化によるC5a及びC5bの産生を阻害する事で、神経筋接合部でのアセチルコリン受容体の消失と、それに伴う神経筋伝達障害を改善すると考えられている。
難治性の全身型重症筋無力症の治療は、第1選択が経口ステロイド、第2選択がタクロリムスやシクロスポリンのカルシニューリン阻害薬、第3選択が免疫グロブリン静注療法及び血漿交換とされている中、「ソリリス®点滴静注」は第3選択でも治療困難な患者の治療選択肢となる。
海外では難治性の全身型重症筋無力症に関して、2017年8月に欧州で、2017年10月に米国で承認されている。
「ソリリス®点滴静注」の投与に於いて、2016年8月23日、京都大学医学部付属病院で治療を受けていた発作性夜間ヘモグロビン尿症の女性患者が、妊娠に伴い血栓症予防のため本剤を投与。
その後、副作用による急激な発熱に見舞われ、髄膜炎菌敗血症で死亡する事案が発生した。
ソリリスの添付文書には、重大な副作用として「髄膜炎菌感染症を誘発する」と記載されているにも関わらず、京都大学医学部付属病院内の産科の助産師が、発熱の初期段階で髄膜炎菌感染症を疑い、抗菌剤による治療が行われなかった(助産師の範囲を超える)。医師の診断が必要だったにも関わらず情報が共有されなかったとする、事故調査委員会の報告書が出された。
http://www.kyoto-np.co.jp/top/article/20170710000020
いかなる薬でも副作用は起こるもの。早い適切な処置によって助かる症状が大多数であり、そのためにも、患者自身も、医師も、どのような薬剤を使っているかを、多くの診療科や医師に伝える事…無駄に思えるような事でも共有する事が、万が一を救う。
知っているだろう…は、不測の事態を招く恐れがある。
*これは国内での唯一の死亡例である。
↧
December 24, 2017, 6:04 am
今回、医師主導治験(*本文末尾参照)を開始したのは、希少がんの中でも更に発症頻度の極めて少ない、“子宮癌肉腫”を対象に、新規の抗体薬物複合体(ADC=Antibody-drug conjugate)『DS-8201』で、国立研究開発法人 国立がん研究センター中央病院など全国7つの医療施設で、12月4日から始まった──。
試験ID番号、UMIN000029506の試験が実施されるのは、◆国立がん研究センター中央病院、◆埼玉医科大学国際医療センター、◆静岡県立がんセンター、◆愛知県がんセンター中央病院、◆兵庫県立がんセンター、◆四国がんセンター、◆九州がんセンターの7施設です。![子宮癌肉腫治療薬・抗体薬物複合体DS-8201のイメージ写真]() 子宮癌肉腫治療薬・抗体薬物複合体「DS-8201」は、
子宮癌肉腫治療薬・抗体薬物複合体「DS-8201」は、
医師主導治験を開始したばかりであり、製品写真はありません。
*写真はイメージです。
日本国内に於ける子宮体がん(子宮頸がんは除く)の年間発症数は約13,600例、死亡数は約2,200例です(人口動態統計2014年)が、2014年の子宮癌肉腫の発症数は475例で、その死亡数については把握されていません。
その理由として、子宮癌肉腫の疾患概念が、いまだ確立されておらず、子宮体がんに対して推奨される化学療法とは異なっており、子宮癌肉腫に対する標準治療は、世界的にも未だ確立されていないためです。
病期によらず、治癒切除が可能と考えられる場合には、一般的に手術が実施されます。
また治癒切除が困難な場合であっても、性器出血に対し、止血目的の子宮全摘出術が先行される例も多く、リンパ郭清術(手術時がんを切除するだけでなく、がんの周辺にあるリンパ節を切除する事)についてはI期~III期症例の生命予後を改善する事が、米国から報告されています。
切除不能の子宮癌肉腫に対する薬物療法は、子宮体がんに準じて行われますが、選択肢は限定的で、予後不良の疾患です。子宮癌肉腫においては、『HER2受容体』が過剰発現している事が報告されています。
![子宮がん細胞のHER2遺伝子増殖とHER2受容体過剰発現]() 子宮癌肉腫細胞に過剰発現する「HER2受容体」と増殖する「HER2遺伝子」。
子宮癌肉腫細胞に過剰発現する「HER2受容体」と増殖する「HER2遺伝子」。
国立がん研究センター中央病院で治療を実施した患者の腫瘍組織を解析した所、HER2が3+と判定された患者が8.3%、HER2が2+と判定された患者が36%、HER2が1+と判定された患者が33%、HER2陰性と判定された患者が23%となり、45%弱の患者でHER2が2+以上の過剰発現患者でした。『DS-8201』は、第一三共株式会社が創製した、HER2タンパク質に対する抗体薬物複合体で、抗HER2抗体とトポイソメラーゼ阻害薬の“DXd”を結合させた、分子標的薬抗体薬物複合体製剤です。
抗体薬物複合体(Antibody Ddrug Conjugate)は、がん細胞に発現している標的分子(HER2)に結合する抗体を介して、薬物をがん細胞に直接届け、がん細胞のDNAを直接破壊するものです。
![抗体薬物複合体DS-8201の仕組み]() トポイソメラーゼ阻害薬“DXd”は、癌細胞に運ばれると、癌の細胞核DNAに結合し
トポイソメラーゼ阻害薬“DXd”は、癌細胞に運ばれると、癌の細胞核DNAに結合し
DNAの複製を阻止して癌細胞核の内部から直接破壊する。
これまでの抗体薬は、HER2に結合して免疫細胞の攻撃を援護する物でしたが、がん細胞内のDNAを直接攻撃できるので、薬物の全身曝露を抑えつつ、がん細胞への攻撃力を高める事が出来ます。
尚、今回の試験は、子宮癌肉腫に発現するHER2蛋白質を標的とした分子標的薬として、世界初の医師主導治験だと言う事です。
『DS-8201』は、既に、第一三共株式会社主導で実施された、日米第I相臨床試験(標準的治療が不応又は不耐となったHER2陽性の再発・転移性乳がんや胃がん患者を対象にDS-8201の安全性、忍容性および予備的有効性を評価した試験)で良好な結果が得られ、米国食品医薬品局(FDA)よりHER2陽性の再発・転移性乳がん治療を対象として「画期的治療薬(Breakthrough Therapy)」に指定された。
『DS-8201』は、第一三共株式会社主体で、乳がん、胃がん等を対象とした臨床試験が進められていますが、発症頻度の極めて少ない子宮癌肉腫を対象にした試験は行われていない。![ペタしてね月]()
▼海外では既に承認されている。
▼或いは、既に標準薬として確立されている薬物。
▼日本国内の臨床現場でも必要性があるが、承認されていない医薬品。
▼採算性等の理由により製薬企業が治験を行わない。
▼製薬企業が採算性などの理由で興味を示さない。
▼そのため、医師自らが治験を実施することを制度上可能にした。
▼治験目的が明確化されている。
と、公益社団法人日本医師会 治験促進センター医師主導治験、及び厚生労働省の「医師主導治験の現状と課題」に記載されています。
そして、全ての関係者が、医師主導の治験は社会貢献である事の再認識が必要がある、と記されている。
『医師主導の治験』は、治験の準備から管理を医師自ら行う事であり、治験を実施する事により、その医薬品や医療機器の薬事承認を取得し、臨床の現場で適切に使えるようにする事が可能となります。
是非とも、有意な結果がもたらされる事を期待したい!
↧
December 29, 2017, 8:21 am
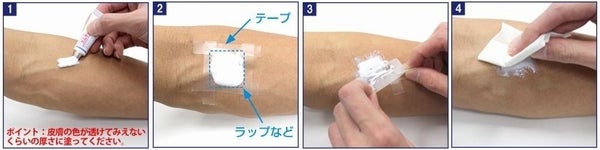
佐藤製薬株式会社(本社:東京都港区元赤坂)は、2017年3月23日に製造販売承認を取得した、外用局所麻酔剤「エムラ®パッチ」を12月13日に発売したと発表しました。
「エムラ®パッチ」は、既に発売されている外用局所麻酔剤「エムラ®クリーム」の新しい剤形で、ワンタッチで処置できる利便性の高い貼付剤(ちょうふざい又は、てんぷざい)です。
![外用局所麻酔剤エムラパッチ]() 皮膚レーザー照射療法時の疼痛緩和、又は注射針・静脈留置針穿刺(せんし)時の
皮膚レーザー照射療法時の疼痛緩和、又は注射針・静脈留置針穿刺(せんし)時の
予定部位の疼痛緩和用外用局所麻酔剤「エムラ®パッチ」
患者にとって治療や処置に伴う痛みは、一時的な辛さでは終わらず、痛みが記憶として残るため、次回以降の治療や処置が、より困難になるなど長期的な影響を与える事が分かって来ました。
特に小児では、痛みを伴う医療行為(注射を打つ時の針に対する恐怖心など)を受ける事に大きな精神的負担を感じる事から、治療や処置に伴う疼痛を緩和する事は、小児患者やご家族にとっても、負担の軽減につながると考えられます。注射時の刺す痛みが感じられなければ、その後、針に対する恐怖心は相当軽減されるでしょう。![エムラクリームの使用方法]() 既発売のエムラクリームの使用方法。
既発売のエムラクリームの使用方法。![エムラパッチの使用方法]() 新剤形エムラパッチの使用方法。
新剤形エムラパッチの使用方法。
【製品概要】
【製品名】:エムラ®パッチ
【成分・含量(1枚中)】:
▼日局リドカイン25mg、▼プロピトカイン25mg
【性状・剤形】:貼付剤
▼大きさ:約60mm×約70mm(薬液を含む部分:直径約35mm)
【効能・効果】
(1).皮膚レーザー照射療法時の疼痛緩和
(2).注射針・静脈留置針穿刺時の疼痛緩和
【用法・用量】:
<成人>
通常、成人には、レーザー照射予定部位、又は注射針・静脈留置針穿刺予定部位に60分間貼付する。尚、1回あたりの貼付枚数は10枚までとし、貼付時間は120分を超えないこと。
<小児>
通常、小児等には、レーザー照射予定部位、又は注射針・静脈留置針穿刺予定部位に60分間貼付する。尚、1回あたりの貼付枚数及び貼付時間は下表を超えないこと。
年齢(月齢) 体重 最大貼付枚数 最大貼付時間
0~2ヶ月 / 1枚 60分
3~11ヶ月 5kg以下 1枚 60分
5kg超 2枚 60分
1~14歳 5kg以下 1枚 60分
5kg超10kg以下 2枚 120分
10kg超 10枚 120分
【製品特性】:
エムラ®パッチは、リドカイン、プロピトカインを等量ずつ混合した共融混合物で、正常皮膚における皮膚透過性を高めたパッチタイプの外用局所麻酔剤です。貼付剤のため、一定量の薬剤を確実かつ簡単に塗布できます。
【薬価】:251.6円/枚(薬価収載日:2017年11月29日)
【副作用の注意】:新生児ではメトヘモグロビン血症に注意が必要。その他はエムラクリームと同様。今年一年、当ブログに訪問して頂きありがとうございます。
皆様、どうぞ良い年をお迎えください。
↧
2018年が始まりました。明けましておめでとうございます。
2017年が良い年だった方は、本年も良い年になりますように…
2017年に不運があった方は、本年が幸運の年になりますように…
新たな年が、全ての皆様方にとって、笑顔に包まれる日、健康で送られる日の多い1年になりますように。
![線]()
![ペタしてね鳥]()
容易く、本人の意思とは関係なく、命を絶たれてしまった人がいます。
その最悪の報に接した時、あなたはどんな事を思うでしょうか‥‥?
悲痛な叫びが誰にも聞こえないまま。
助けを呼ぶ声さえ発せないまま、不条理の凶行に倒れた人たちの声ならぬ声が‥‥
本数字は、平成29年都道府県別 殺人事件等被害死亡犠牲者数です。(警察庁発表の犯罪認知件数とは異なります)
~表の数値の読み方~
◆この数字は、死亡者数(被害者数)のみを単純集計しています。事件発生後、病院等で死亡が確認された場合も加えています。
(全国ニュース、全国ウェブニュースチャンネル、各都道府県の新聞報道、ニュース配信会社の配信報道:時事通信などより毎日加算集計)
◆強盗致傷、放火、自動車事故(殺人と認定された1件のみ含む)等は含まず。
その後不起訴になった事案も被害者が死亡している場合は、いずれかに含む。
◆殺人未遂や暴行傷害について…
被害者がその後死亡した場合は各項目に加算していますが、重体や意識不明の場合は加算しない。
小児は15歳未満又は中学生以下。虐待は死亡した場合のみ。児相預かりも含まず。
◆無理心中について…
一方が他方を殺害後に自殺した場合は、1件の殺人と1件の変死体と見なす。
但し、煉炭自殺や同時入水死は自死とし、カウントしない。
◆死体遺棄又は死体放置とは…
ご遺体発見時、病死や老衰で死亡したにも関わらず、死亡届未提出の場合、及び事件性があり殺害され埋められたり、死体を損壊、又は放置された場合。
証拠隠滅目的の為発見困難な場所に隠匿した場合。
◆変死体とは…
ご遺体発見時、既に白骨化し、身元も死因も特定されない場合、及び事件か自殺か事故か不明の場合。電車等への飛び込み及び高層階からの飛び降りは含まず。
尚、加害者や容疑者がその後、不起訴や処分保留になった場合は、殺人事案は変死、暴行・虐待死はそのまま、傷害致死もそのままカウントしています。
(殺人未遂・傷害致傷を加えた場合は、総合計が1000人以上となりますが、立件されない場合も多く逮捕だけでは判断できない)
順位は敢えて掲載していません。
凶悪犯罪、及び殺人・傷害致死・暴行死ともに毎年、減少傾向にありますが、
昨年は親族や家族による殺人事案が多く発生しました。
またこれらの事件の最多発生月は、2017年7月と8月と12月の各41件。一昨年の最多は2016年7月の44件で、お酒を飲む機会の増える盆と年末に多く発生しています。
高齢化に伴う先行き不安や、認知症・介護疲れも多く発生しました。
しかし、親族間の殺人事件が『0』と言う県も多くあります。
そうした地域は何が他と違うのかを真摯に見つめ直す事で、高齢化社会のミチシルベになるのかもしれません。
↧
↧
January 5, 2018, 11:45 pm
↧
January 14, 2018, 3:15 am
↧
January 19, 2018, 7:51 am
↧
January 28, 2018, 8:33 am
千寿製薬株式会社(本社:大阪府大阪市中央区)は1月19日、厚生労働省より未熟児動脈管開存症治療剤として、「イブリーフ®静注20mg(一般名:イブプロフェン L-リシン)」の製造販売承認を取得したと発表しました。
「イブリーフ」の開発に当たっては、日本未熟児新生児学会(現:日本新生児成育医学会)が、厚生労働省に未承認薬・適応外薬の要望書を提出。
開発支援品目として選定された後、開発企業が公募され、千寿製薬株式会社が開発を受諾。
未承認薬等開発支援センターの助成金を活用して、国内での開発を進めていたものです。
![イブリーフ静注20mg_イブプロフェンL-リシン剤]() *製品の参考写真(国内品とは異なります)
*製品の参考写真(国内品とは異なります)
米国で2006年7月に未熟児動脈管開存症治療剤として発売された
イブプロフェン L-リシン静注(Ibuprofen-Lysine Injection)製剤10mg
日本国内承認品は「イブリーフ®静注20mg」で1バイアル(イブプロフェンとして20mg)×3
動脈管は、胎児が母親のお腹の中にいる時は肺呼吸をしていないので、卵円孔(らんえんこう)と共に、胎児の血液循環系に見られる血管で、肺動脈と大動脈とを連結して肺への血液循環をバイパスしている血管の事を言います。
動脈管があるおかげで、空気の無い子宮内でも、胎盤を通して酸素を効率良く取り込む事が出来ています。
出産により肺が機能を始めると、卵円孔と共に生後2日~2週までに狭搾し閉じて、肺への血液循環が始まります。
しかし、この動脈管が自然に閉じずに残っているものを『動脈管開存症』と言います。
◇卵円孔(らんえんこう)は……胎児期の心臓の左右の心房を貫く孔(あな)の事で、生後間もなく、肺呼吸開始に伴って閉じます。
![未熟児動脈管開存症]() 動脈管閉鎖前(胎盤呼吸)と閉鎖後(肺呼吸の始まり)。
動脈管閉鎖前(胎盤呼吸)と閉鎖後(肺呼吸の始まり)。
しかし、インドメタシンは腎臓、胃腸、及び脳灌流(のうかんりゅう=脳へ血を送る事)に影響を及ぼすため、インドメタシンの使用に関する安全性に懸念があり、更に一時的な腎機能障害を招く場合がある事から、新しい薬剤が求められていました。
2006年4月、米国食品医薬品局(FDA)は、未熟児の臨床的に重要な未熟児動脈管開存症(PDA)の閉鎖にイブプロフェン-リシン(NeoProfen)を使用する事を承認。イブプロフェン-リシンは、副作用が少なく、尚且つインドメタシンと同等に有効である事が示されています。
イブプロフェンは、プロスタグランジン(血管平滑筋を収縮させる作用の生理活性物質)合成の阻害を介して作用すると考えられている。 ◆国立バイオテクノロジー情報センター(アメリカ国立医学図書館)の「Ibuprofen lysine (NeoProfen) for the treatment of patent ductus arteriosus(動脈管の治療のためのイブプロフェンリジン)」に関する米国食品医薬品局(FDA)の承認要覧により。
【注釈】
◆尚、市販薬のイブプロフェン鎮痛解熱剤は最低用量、及び中用量の低濃度な製品のため、連続投与しない限り、腎機能障害を起こす事はありません。これはインドメタシン貼り薬/塗り薬でも同様です。
◆動脈管開存症に使われているインドメタシン、及び今回のイブプロフェン L-リシン製剤は高濃度で、静脈内点滴するもので、市販薬とは異なります。【製品概要】
【製品名】:イブリーフ®静注20mg
【一般名】:イブプロフェン L-リシン
【剤形・含量】:1バイアル2mL中にイブプロフェン L-リシンとして34.18mg(イブプロフェンとして20mg)を含有する水性注射剤
【効能・効果】:下記疾患で保存療法(水分制限、利尿剤投与等)が無効の場合。
未熟児動脈管開存症。
【用法・用量】:通常3回、イブプロフェンとして初回は10mg/体重1kg、2回目及び3回目は5mg/kgを15分以上かけて、24時間間隔で静脈内投与する。
【使用上の注意】:
▼ 新生児医療及び未熟児動脈管開存症患者の管理に習熟した医師が使用するか、又はそれら医師の監督下で使用すること。
▼ イブプロフェンはアルブミン結合部位からビリルビンを置換させることがあるので、総ビリルビンの上昇がみられる患者では、黄疸の発現に注意し、慎重に投与すること。
▼ 他のプロスタグランジン合成阻害剤と同時に投与しないこと。
「イブリーフ®静注20mg」は、治験症例が限られているため、発売後において「一定数の症例に係るデータが集積されるまでの間は、全症例を対象とした使用成績調査(全例調査)を実施する」旨の承認条件が付されている。
このため、当該承認条件が解除されるまでは、使用成績調査に協力できる施設に限定して使用するよう、当局から指導を受けていると言う。
本剤は米国で2006年7月に未熟児動脈管開存症治療剤として発売。また、イブプロフェン L-リシンの活性体であるイブプロフェンフリー体の静注製剤も、EUで2004年9月に発売され、2017年6月時点で46の国と地域で製造販売されている。
なお、同剤は薬価基準収載後の発売を予定しており、現在のところ、2018年6月頃の発売を見込んでいる。また販売元は武田薬品工業となる。
↧
↧
February 2, 2018, 8:16 am
↧
February 11, 2018, 8:55 am
アストラゼネカ株式会社(本社:大阪府大阪市北区)は1月19日、「(既存治療によっても喘息症状をコントロールできない難治の患者に限る)気管支喘息」を効能・効果とした、「ファセンラ®皮下注30mgシリンジ(一般名:ベンラリズマブ(遺伝子組換え)」の国内に於ける製造販売承認を取得したと発表した。
![ファセンラ皮下注30mgシリンジ_Fasenra]() 重症/難治性気管支喘息治療薬「ファセンラ®皮下注30mgシリンジ」
重症/難治性気管支喘息治療薬「ファセンラ®皮下注30mgシリンジ」米国食品医薬品局(FDA)承認販売名「Fasenra™ Injection(benralizumab)」
重症喘息について…、
日本では約1,177万人が喘息に罹患していると推定されています(厚生労働省 厚生労働統計一覧2014 主な傷病の総患者数・平成26年10月)。
このうち、高用量吸入ステロイド薬に加えて、その他の長期管理薬(及び/又は全身性ステロイド薬)による治療を要する喘息患者、或いはこうした治療にも関わらず「コントロール不良」である喘息を、『重症喘息』と定義され、喘息患者全体の5~10%に該当するとされています(一般社団法人日本アレルギー学会 喘息ガイドライン専門部会 監修:喘息予防・管理ガイドライン 2015)。
コントロール不良の『重症喘息』は死に至る事もある過酷な疾患であり、“喘息予防・管理ガイドライン 2015”によると、喘息による死亡者数は2013年が1728人、2014年が1550人と新しい薬剤の登場で、減少傾向にあるものの、吸入や服薬、注射のわずらわしさから、勝手に中断してしまう患者も多く、これが病勢悪化を招いています。特に、既存の喘息治療で症状のコントロールが出来ない『重症喘息』患者は、頻繁に起こる“喘息悪化”や“呼吸機能の低下”により、高い喘息死リスクと、生活の質(QOL)の著しい低下などで、身体的・経済的な負担を強いられます。その為、2017年10月、日本アレルギー学会から厚生労働省に、「ファセンラ」の早期承認を求める要望書が提出されていました。
「ファセンラ®」は、ヒト化抗IL-5受容体αモノクローナル抗体製剤で、身体の免疫システムをになう白血球の一種である『好酸球』の表面に発現するインターロイキン-5受容体αに直接結合し、増強された抗体依存性細胞傷害活性(ADCC活性)によって、ナチュラルキラー細胞(NK細胞)等を誘導することで、『好酸球』のアポトーシス(プログラム細胞死)を引き起こし、『好酸球』を直接的かつ速やかに、ほぼ完全に除去します。
この作用機序により、血中だけでなく喀痰中や気道組織中に潜在する『好酸球』まで除去されます。
重症喘息患者の約50%で好酸球値が高い傾向がありますが、好酸球レベルが上昇すると、気道炎症や気道過敏性を引き起こし、その結果、喘息の悪化や呼吸機能の低下を起こし、喘息が重症化します。
「ファセンラ®」は、針刺し防止機能付きプレフィルドシリンジの注射剤で、1回30mgを初回、4週後、8週後に皮下に注射し、以降、8週間隔で皮下に注射します。
類薬に「ヌーカラ皮下注用(2016年6月10日発売)」がありますが、ヌーカラは4週間毎であるのに対し、「ファセンラ®」は呼吸器生物学的製剤で初めての8週間隔維持投与製剤です。
また作用機序も多少異なり、「ヌーカラ」はヘルパーT細胞が産生するIL-5と結合するのに対し、「ファセンラ®」は好酸球に発現するIL-5受容体と結合し、IL-5との結合を阻害します。【ファセンラ®皮下注30mgシリンジの製品概要】
【製品名】:ファセンラ®皮下注30mgシリンジ
【一般名】:ベンラリズマブ(遺伝子組換え)
【剤 型】:注射剤(プレフィルドシリンジ)
【効果・効能】:気管支喘息(既存治療によっても喘息症状をコントロールできない難治の患者に限る)
【用法・用量】:通常、成人にはベンラリズマブ(遺伝子組換え)として1回30mgを、初回、4週後、8週後に皮下に注射し、以降、8週間隔で皮下に注射する。
◎ファセンラは、固定用量があらかじめ充填された“プレフィルドシリンジ”の注射剤で、皮下に注射します。
【製造販売承認】:2018年1月19日
【補足事項】
重症喘息患者が一刻も早く、「ファセンラ」の治療が開始できるよう、アストラゼネカ株式会社は、厚生労働省の定める『保険外併用療養費制度』のもとで、薬価収載までの期間、「ファセンラ」の倫理的無償提供を実施します。
「ファセンラ」の倫理的無償提供の対象施設は、本剤開発の治験を実施した施設のうち、承認された効能・効果、及び用法・用量に従ってのみ使用する事。
尚且つ、倫理的無償提供期間中にアストラゼネカ株式会社が実施する、適正使用推進のための活動に協力する事に同意された施設に限定されます。
この倫理的無償提供は、各施設の受入れ準備が整った時点から開始し、薬価収載前日に終了する。「ファセンラ®皮下注」の国内販売承認は、2017年11月14日の米国食品医薬品局(FDA)による承認、2018年1月10日の欧州委員会(EC)による販売承認に続く、迅速承認となります。
↧
February 19, 2018, 3:10 am
佐藤製薬株式会社(本社:東京都港区元赤坂)は1月19日、ホスラブコナゾール L-リシンエタノール付加物を有効成分として含有した、経口抗真菌爪白癬治療薬「ネイリン®カプセル100mg〈一般名:Fosravuconazole L-Lysine Ethanolate〉」について、「皮膚糸状菌(トリコフィトン属)による爪白癬」を効能・効果とする医薬品製造販売承認を取得したと発表した。
「ネイリン®カプセル100mg」は、新有効成分含有医薬品であり、再審査期間は8年。![爪白癬治療薬ネイリンカプセル100mg]() 経口抗真菌爪白癬治療薬「ネイリン®カプセル100mg」
経口抗真菌爪白癬治療薬「ネイリン®カプセル100mg」
<ホスラブコナゾール L-リシンエタノール付加物>
この白癬菌が足に存在していれば、足白癬(水虫)で、爪の中に侵入すると爪白癬となります。
![皮膚糸状菌]() 爪白癬の原因菌=皮膚糸状菌(トリコフィトン属)
爪白癬の原因菌=皮膚糸状菌(トリコフィトン属)
真菌(カビ菌)には様々な種類があり、
大別では爪白癬は「白癬菌」と呼ぶ。
皮膚糸状菌(トリコフィトン属)は、私たちの皮膚を覆っている角層や爪、髪の毛などに住み着き、これらの感染症を引き起こします。
爪白癬は、日本人の10人に1人(足白癬=水虫は5人に1人)、約1,250万人が罹患していると報告されています(第60回日本医真菌学会 シンポジウム8-1 爪真菌症の疫学2017/4/6)。「ネイリン®カプセル100mg」の有効成分である『ホスラブコナゾール L-リシンエタノール付加物』は、エーザイ株式会社(本社:東京都文京区小石川)が創製した、新規のトリアゾール系抗真菌剤で、経口の爪白癬治療剤としては、約20年ぶりの新薬誕生となります。
![皮膚糸状菌の細胞壁]() 皮膚糸状菌の細胞壁
皮膚糸状菌の細胞壁
『ホスラブコナゾール(Fosravuconazole)』は、新規の経口抗真菌剤であり、主活性成分の「ラブコナゾール(Ravuconazole)」の溶解性や生体内利用率を向上させた*プロドラッグで、ヒトに経口投与すると速やかに「ラブコナゾール」に変換される。
*プロドラッグは……それ自体は薬理活性を全く持たないが、体内で代謝される事により活性化し、薬効を発揮する薬剤で、胃腸障害などの副作用を軽減できる。
ネイリン®カプセルの作用機序![ネイリンカプセルの作用機序]()
「ラブコナゾール」は、真菌細胞の膜成分であるエルゴステロール(Ergosterol)生合成を阻害することにより、抗真菌作用を現します。
本剤の適応症である爪白癬は、病状が進行すると、爪の肥厚に伴う痛みや歩行困難等のQOL(生活の質)の低下を生じさせる可能性があり、また、未治療のまま放置する事で、足白癬(水虫)の再発や家族内感染の引き金になり得る疾患です。
爪白癬に適応を有する薬剤として、経口剤及び外用液剤が臨床応用されており、経口投与の類薬にはイトリゾールカプセル(=パルス療法/一般名:イトラコナゾール)やラミシール錠(テルビナフィン塩酸塩)がありますが、重篤な副作用や、併用禁忌薬が多くあり、また爪の表面が白く濁った症例には効果が期待できませんでした。
新規の塗り薬など、治療選択の幅は広がっていますが、爪白癬の治療ゴールである完全治癒を達成するためには、より治療効果が高く、安全で、利便性を兼ね備えた新たな抗真菌薬が望まれて来ました。
佐藤製薬は、爪白癬患者を対象とした国内第III相臨床試験を実施し、本剤の有効性と安全性を確認したことから、2017年1月に製造販売承認申請を行った。
【製品概要】
【販売名】:ネイリン®カプセル100mg
【一般名】
<和名>:ホスラブコナゾール L-リシンエタノール付加物(JAN)
<洋名>:Fosravuconazole L-Lysine Ethanolate(JAN)
【成分・含量】:(1カプセル中)ホスラブコナゾール L-リシンエタノール付加物169.1mg(ラブコナゾールとして100mg)
【効能・効果】
<適応菌種>皮膚糸状菌(トリコフィトン属)
<適応症>爪白癬
【用法・用量】:
通常、成人には1日1回1カプセル(ラブコナゾールとして100mg)を12週間経口投与する。
【包装】:84カプセル(PTP 14カプセル×6)
【用法・用量に関連する使用上の注意】
●投与終了後は、爪の伸長期間を考慮して経過観察を行うこと。尚、本剤は、新しい爪が伸びて来ない限り、一旦変色した爪所見を回復させるものではない。
↧
February 24, 2018, 9:21 am
アルツハイマー病の新薬として最近、注目されていた3種類の薬剤について、1月~2月、相次いで臨床試験が失敗に終わり、開発中止の論文の掲載、又は発表がなされた事が分かった。
研究者たちが注目していた、アルツハイマー病に関係すると考えられている、脳のアミロイドβ(ベータ)と呼ばれるタンパク質を標的に、蓄積する前に除去を促す新薬の臨床試験で、ことごとく、認知機能の低下の有意な抑制は示されなかった、と報告された。
◆Journal of the American Medical Association(JAMA⇒ジャーナル・オブ・ジ・アメリカン・メディカル・アソシエーション=米国医師会誌)の2018年1月9日号に掲載された論文で、アルツハイマー病患者に対して選択的セロトニン5-HT6受容体拮抗薬であるIdalopirdine(イダロピルジン=大塚製薬株式会社/ルンドベック社)の有効性が示されなかったとする臨床試験の成績が報告された。
◆その後、Eli Lilly社(日本イーライリリー社)が開発を目指していた抗アミロイドβ(Aβ)抗体薬のsolanezumab(ソラネズマブ)についても、同薬による認知機能の低下の有意な抑制は示されなかったとする臨床試験の結果が「New England Journal of Medicine」1月25日号に掲載された。
◆また、米Merck社(メルク・アンド・カンパニー/MSD社)は2月13日、アミロイド前駆体タンパク質βサイト切断酵素1の低分子阻害剤「ベルベセスタット」(MK-8931)を、アルツハイマー病による健忘型軽度認知障害(Prodromal AD)患者を対象に評価する第3相試験を中止する事を発表した。試験のデータは今後の学会で発表する予定だと言う。
今回の決定は、安全性中間解析に基づき、全般的な満足や恩恵、及びリスクを検討した結果、試験を継続した場合のリスクを上回る満足な結果が得られる可能性は低いと結論づけた。
<アミロイドβのみ標的とした研究に限界か>有望視されていたアルツハイマー病の新薬の開発が相次いで中止され、一部の専門家から、研究の方向性を疑問視する声が上がっている。その一方で、これまでのアルツハイマー病研究で見逃していたものが何だったのか?
研究者たちによる新たな探求が続けられている──。米アルツハイマー病協会(AA)のJames Hendrix氏は…
「10年前に比べ、研究資金が拡充されつつあり、アミロイドβ以外にも、タウやニューロンの炎症、脳のエネルギー利用といった様々な因子について、研究が行われるようになって来た──。アルツハイマー病を発症しても、記憶力をある程度維持したまま、他の原因で死亡するまで進行を遅らせる事ができれば、治療の成功と言えるだろう」
と、話している。これまで主犯格と見られてきたアミロイドβ……
ところが10年に及ぶ臨床研究・試験の結果、アミロイドβを蓄積させる『黒幕』が存在するかもしれない、と言う報告が相次いだ事で、これまでに注ぎ込んだ莫大な研究開発費は、無駄に終わった、のか?
いや、そうではない。
これは次なる目標への挑戦の節目と言えるだろう──。
人間の英知は、まだまだAIに追い越される事はない! あらゆる謎が解き明かされるまで、人間の挑戦は続く──。
↧
↧
↧
↧
富士製薬工業株式会社(本社:東京都千代田区三番町)は2月26日付けで、レボノルゲストレル(levonorgestrel)を含有する緊急避妊薬について、国内初となるジェネリック医薬品の製造販売承認申請を行い、受理されたと発表した。
![ノルレボ錠1.5mg]() 国内で唯一の緊急避妊薬「ノルレボ®錠」
国内で唯一の緊急避妊薬「ノルレボ®錠」
あすか製薬:1.5mgは2016年4月15日販売開始。
有効成分のレボノルゲストレル(合成黄体ホルモン)は、WHO(世界保健機関)による緊急避妊のエッセンシャルドラッグ(=その国の保険医療に最低限必要な医薬品)に指定されており、本剤による緊急避妊法は効果が高く、安全性にも優れていると言われており、世界の多くの国で使用され、日本国内に於いても、標準的な方法として用いられています。![ノルレボ錠1.5mgの作用機序]() 「ノルレボ®錠(レボノルゲストレル)」の作用機序
「ノルレボ®錠(レボノルゲストレル)」の作用機序しかし、「ノルレボ®錠」は薬価未収載品で、保険適応から除外されており、1錠当たり1万5000円前後と見られ、患者の経済的負担が大きい製剤である事から、以前より、多くの医療機関から「ノルレボ®錠」のジェネリック医薬品(後発品)の開発要望が出されていました。
「ノルレボ®錠」は現在、1.5mg錠のみが発売されている(0.75mgは販売終了)。
富士製薬工業株式会社が今回申請したのも1.5mg錠で、1回1錠の服用で用いる。
本剤は、卵胞ホルモンを含有しないため、服用後の吐き気が今まで使用されている製剤に比べ少ない。
問題の価格について富士製薬広報部は、「ノルレボ®錠」の後発品がどの程度になるか、答えられないとしながら、開発経緯に患者の経済的負担もある事から、これを考慮し、今後検討して行く、と話した。
↧