■7月30日、京都大学医学部付属病院がiPS細胞(人工多能性幹細胞)を使ったパーキンソン病患者の脳に移植する医師主導の臨床試験(治験)を8月1日から始めると発表、大きなニュースとなって日本中を駆け巡りました――。
これまでは薬剤でドーパミンを補い、神経細胞間の情報伝達を助けて来ましたが、iPS細胞を使った神経細胞の補充という、新たな治療法が開けると期待されてます。
京都大学の高橋淳教授らは、この医療が保険適用を受けて、治療費全体で「将来的に数百万円くらい」を目指す、と話しています。心臓ペースメーカーやICD(植込み型除細動器)が130~150万円程度で、高額医療費助成制度を利用すると3割負担で40~45万円ほどなので、決して高くはないと言う所でしょうか…。その13日前――。
7月17日、量子科学技術研究開発機構(QST)は、脳幹などの深部に発生する脳組織に直接浸潤している【悪性脳腫瘍】の患者を対象とした、放射性治療薬「64Cu-ATSM」の治験薬を使用した第1相臨床試験を、国立がん研究センター附属病院で開始したと発表した。
放射性治療薬「64Cu-ATSM」は、国立研究開発法人 量子科学技術研究開発機構の量研放射線医学総合研究所・吉井幸恵主幹研究員らと、国立がん研究センターの栗原宏明医長、成田善孝科長らと共同で開発した日本発の放射性治療薬で、今回、製剤化に成功し、共同で悪性脳腫瘍患者対象とした第1相臨床試験を開始したもの――。『脳腫瘍』の治療は、腫瘍の位置と種類によって異なり、その分類は組織学的に150にもなります。悪性の原発性脳腫瘍のうち、最も多いのは神経膠腫(しんけいこうしゅ=グリオーマ)です。
神経膠腫には幾つかのタイプがあり、神経膠腫は原発性脳腫瘍全体の65%を占めています。
可能な場合は、頭蓋骨を開く開頭手術で腫瘍を摘出します。
脳に殆ど、または全く損傷を与えずに摘出できる脳腫瘍もあります。しかし、脳腫瘍の多くは非常に際どい位置に発生するため、従来の手術では重要な脳の構造を破壊せずに摘出する事が困難、または不可能です。
『悪性脳腫瘍』では、多くの場合、手術、放射線療法、化学療法が併用されますが、再発した場合の有効な治療法が確立していないのが現状です。〔MSDマニュアル家庭版 09.脳、脊髄、末梢神経の病気//神経系の腫瘍「脳腫瘍」より〕
化学療法(抗がん剤)が効きづらい事が大きな理由で、その原因として、悪性脳腫瘍は活発に増殖するため、血管新生が追い付かず、酸素の供給が乏しい低酸素環境になり、低酸素環境に置かれた悪性脳腫瘍に於いては、既存の治療法の効果が弱まってしまう事が知られています。
今回、製剤化に成功した「64Cu-ATSM」は、低酸素化した治療抵抗性腫瘍を体内から攻撃する、新しいメカニズムの治療法です。「64Cu-ATSM」は、“放射性核種64Cu(銅の放射性同位体)”を使用した64Cu-ATSM(64Cu-ジアセチル-ビス=N4-メチルチオセミカルバゾン)で、放射性核種64Cu(物理学的半減期12.7時間)は、既存の放射性治療薬(*I-131や90-Y)で放出されるベータ線の他に、がん細胞DNAを効果的に損傷できるオージェ電子を放出するため、がん細胞に対し、高い殺傷効果が期待できる。![62Cu-ATSMを取り込んだ悪性脳腫瘍のPET画像]() 「64Cu-ATSM」を取り込んだ悪性脳腫瘍(神経膠腫)のPET/MRI画像
「64Cu-ATSM」を取り込んだ悪性脳腫瘍(神経膠腫)のPET/MRI画像
B)、64Cu-ATSM PET画像。病変で高い細胞取り込みを示している 。
C)、造影剤増強の範囲内で64Cu-ATSM取り込みを示しているPET/MRI合成画像。
D)、強烈なHIF-1α(低酸素誘導性転写因子-1α)免疫反応性を示している抗HIF-1αで傷つけた最も高い64Cu-ATSMの取り込み組織の顕微鏡写真。×200
しかも「64Cu-ATSM」は、腫瘍低酸素環境に高集積する事が明らかになっており、低酸素環境下で治療抵抗性を有する腫瘍に対し、高い治療効果を発揮する。尚、ベータ線は、一般に最大飛程がミリメートルオーダーで、PET検査などと同様、従来の放射性治療薬に使用される。
オージェ電子は、一般に最大飛程がナノメートルオーダーと更に短いため、薬剤の近傍(きんぼう→近い空間)に高いエネルギーを付与する事ができる。
今回始まった第1相臨床試験や今後行われる臨床試験で、「64Cu-ATSM」の安全性・有効性が示されれば、悪性脳腫瘍患者に対する新たな治療の選択肢を提供できる可能性がある、と研究グループは述べている。
↧
厚生労働省の薬事・食品衛生審議会 医薬品第二部会は8月3日、日本イーライリリー株式会社(本社:兵庫県神戸市中央区)が、国内に於ける製造販売承認を申請していた「ホルモン受容体陽性(HR+)且つ、ヒト上皮増殖因子受容体2陰性(HER2-)の手術不能又は再発乳がん」の効能・効果で、サイクリン依存性キナーゼ(cyclin-dependent kinase:CDK)4及び6阻害剤「ベージニオ錠™50mg、同錠100mg、同錠150mg(一般名:アベマシクリブ=Abemaciclib)」について、新有効成分含有医薬品として承認申請を了承した。
本剤は早ければ、来月中にも正式承認される見通し。![進行再発乳がん治療薬ベージニオ錠]() 内分泌療法(ホルモン療法)後に増悪した
内分泌療法(ホルモン療法)後に増悪した
HR+かつHER2-の進行手術不能又は再発乳がん治療薬
サイクリン依存性キナーゼ(CDK4/6)阻害剤
「ベージニオ錠™50mg、同錠100mg、同錠150mg」
(一般名:アベマシクリブ=Abemaciclib)
進行乳癌には、癌が乳房組織から身体の他の部位へと広がった転移性乳癌と、癌が最初に発生した組織の周囲には増殖が認められるものの、身体の他の部位には広がっていない局所進行乳癌があります。〔米国癌学会、癌データ2017〕
進行乳癌(転移性/局所進行性)では、近年特に、腫瘍サブタイプ別の治療方針が提唱されるようになって来ました。〔国立研究開発法人国立がん研究センターがん対策情報センター/乳がん/サブタイプ分類〕
米国で、診断時に病期が進行している患者ほど生存率が低く、診断時の癌の広がりが限局性の患者の5年相対生存率は99%、領域性(乳房内または内胸リンパ節)の患者では85%、転移性の患者では26%です。
5年生存率の推定値は、腫瘍サイズなどその他の要因にも影響を受けます。〔日本イーライリリー株式会社プレスリリースより〕「ベージニオ™錠(Verzenio™)」は、サイクリン依存性キナーゼ(CDK4/6)に対する阻害剤で、サイクリンDと結合する事により効果を現します。
G1…第1次成長期(First growth phase)。
S…DNA合成段階(DNA synthesis phase)。
G2…二次成長期(Second growth)。
M…有糸分裂(Mitosis)。
エストロゲン受容体陽性(ER+)乳癌細胞では、サイクリンD1、及びCDK4/6が網膜芽細胞腫タンパク質(Rb)のリン酸化、細胞周期の進行、細胞増殖を促進する事が示されています。「ベージニオ™錠」は【細胞周期】を停止させ、腫瘍の増殖を抑制すると考えられています。正式承認されれば、ファイザーの乳がん治療薬「イブランスカプセル」に続く、2剤目のCDK4/6阻害薬となる。【用法・用量】
ベージニオ錠、イブランスカプセルともホルモン療法剤(内分泌療法剤)フェソロデックス筋注(一般名:フルベストラント)と併用して用いる。
●ベージニオ錠は通常、1回150mgを1日2回経口投与で用いる。
●イブランスカプセルは通常、1日1回125mgを3週連続投与して、1週間休薬することを1サイクルとして用いる。
【副作用の発現割合】
「ベージニオ錠™(Verzenio™)」の投与を受けた患者で、高頻度に発現した副作用(全グレード、発現率20%以上)は、下痢(90%)、疲労(65%)、悪心(64%)、食欲減退(45%)、腹痛(39%)、好中球減少症(37%)、嘔吐(35%)、感染症(31%)、貧血(25%)、血小板減少症(20%)、頭痛(20%)でした。
![乳癌HER2陰性とHER2陽性の違い]() 乳癌のHER2陰性とHER2陽性の違い。
乳癌のHER2陰性とHER2陽性の違い。
標的の対象となるHER2の高発現によって薬剤の効果が異なる。
試験管内では、「ベージニオ™錠」の連続投与により網膜芽細胞腫タンパク質のリン酸化が阻害され、細胞周期のG1~S期の進行が停止し、細胞の老化やアポトーシス(細胞死)が生じた。
正常細胞のCDK4/6を阻害すると副作用が生じる可能性があり、重篤な副作用が見られる場合もあります。また「ベージニオ™錠」が血液脳関門を通過する事を示唆する臨床的エビデンスも得られています。
本剤は2017年10月4日、ホルモン受容体(HR)陽性かつHER2陰性の乳癌に関する効能・効果で米国食品医薬品局(FDA)から承認を取得している。
↧
↧
サノフィ株式会社(本社:東京都新宿区西新宿)は8月10日、サノフィ・グループのサノフィジェンザイム(希少疾患領域、免疫・炎症領域部門)が、希少性遺伝子性疾患の「ゴーシェ病III型」に対する経口治療薬として、現在開発中の『Venglustat』の第II相臨床試験(LEAP試験)に、1例目の日本人患者が登録されたと発表しました。![ゴーシェ病III型venglustat]() *写真はイメージです。
*写真はイメージです。
ゴーシェ病III型経口治療薬「Venglustat(ベェングラスタット)」は、
第II相臨床試験を開始したばかりであり、製品写真はありません。
遺伝子変異により、ライソゾーム内の酵素で、グルコシルセラミド(GL-1)という糖脂質の分解に関与する酵素で、β-グルコセレブロシダーゼに異常が生じ、この酵素が不足または欠損する事で、糖脂質が分解されずに体内に蓄積し、疲労、貧血、血小板減少、挫傷、骨痛、関節痛、肝臓腫大、脾臓腫大、けいれん発作、骨髄や脳などの主要な器官で、進行性の重度の協調運動障害などが生じます。〔小児慢性特定疾病情報センター 大分類: ライソゾーム病/疾病名:ゴーシェ病〕
【ゴーシェ病の原因染色体&遺伝子座】
「ゴーシェ病」の原因となる染色体は第1番染色体に存在する、GBA遺伝子座の変異に起因します。GBA(glucocerebrosidase)遺伝子は、長腕の1q21にあります。
【日本人の発症数】
発症頻度は民族間で大きな差があり、日本人の発症頻度は4~6万人に1人と推定されており、現在まで約150名の患者が同定されています。
世界的にはアシュケナージ系(東欧)ユダヤ人では900~1000人に1人、非ユダヤ人では6~10万人に1人が発症するとされている。これまで、世界で約1万人が診断されています。
【ゴーシェ病の病型分類】![ゴーシェ病の病型分類]()
◆ゴーシェ病I型は、神経症状を伴わない病型で、発症年齢、骨合併症の有無、肝脾腫の程度において非常に臨床的異質性が大きい病型。
◆ゴーシェ病II型は、乳児期に発症し、肝脾腫に加えて発達遅延、痙攣、頸部後屈などの神経症状を伴い、急速に神経症状が進行します。
◆ゴーシェ病III型は、更にⅢa型、Ⅲb型、Ⅲc型の三つの亜型に分類されます。
- IIIa型は肝脾腫に加えて、若年発症の神経症状(小脳失調、ミオクローヌス、痙攣、斜視など)を呈します。
- IIIb型は、核上性水平注視麻痺を唯一の神経症状とし、それに加えて重篤な臓器症状を呈する亜型であり、早期発症のⅠ型と鑑別が困難な場合があります。
- IIIc型は水頭症、角膜混濁、心弁膜石灰化など極めてユニークな臨床症状を呈する亜型です。これらの亜型以外にミオクローヌス(意志に反する不随意運動)てんかんを主徴とし、肝脾腫の程度が軽い臨床亜型も報告されています。
**ゴーシェ病の非神経系症状に対しては治療選択肢が存在します。
しかし神経症状を伴う病態では、脳内に到達してゴーシェ病Ⅲ型に伴う神経症状に効果を発揮する医薬品は、未だ承認されていません。
〔ここまで日経メディカル、シャイヤー・ジャパンのビプリブ:2番目のゴーシェ病治療用酵素製剤解説/シャイアー・ジャパン治療領域ゴーシェ病ガイドブックより〕
今回始まった第II相臨床試験(LEAP試験)は、2期からなる非盲検の多施設での国際共同試験で、『Venglustat』と既発売の「*セレザイム®(一般名:イミグルセラーゼ=遺伝子組換え)」を併用した治療の安全性と忍容性を検討し、有効性を探索する試験です。
試験の第1期、ゴーシェ病III型の成人患者において、ゴーシェ病I型患者からゴーシェ病III型患者を識別する中枢神経系バイオマーカーを測定し、「Venglustat」による治療に適した患者を特定する。
試験の第2期、ゴーシェ病III型の成人患者における「Venglustat」の安全性と忍容性を検討し、有効性の探索的検討を行い、脳脊髄液中の中枢神経系バイオマーカーの変化を検討する。
![ゴーシェ病のマクロファージ]() ゴーシェ病III型に見るマクロファージの比較。
ゴーシェ病III型に見るマクロファージの比較。
(左)ライソゾーム内の正常な単球(未成熟な白血球)とマクロファージ。
(右)マクロファージに分解されない糖脂質が蓄積、核の位置がズレる。
*現在、ゴーシェ病の治療薬として承認・販売されているのは、サノフィ株式会社「セレザイム®(2011年3月18日発売)」とシャイアー社の「ビプリブ®(2014年9月2日発売)」で、効能・効果はいずれもゴーシェ病の諸症状(貧血・血小板減少・肝臓/脾臓の腫大及び骨症状)の改善となっており、中枢神経症状の進行抑制と改善までに至っていない。
**現時点での中心的治療法は、貧血などの血液学的異常及び臓器障害の改善が期待できる“酵素補充療法”である。
この治療法が、神経症状の改善への効果が期待できない理由として、最大の問題は“酵素”が血液脳関門(BBB)を通過できず、標的となるマクロファージ内に必要量が到達できない事にある。
『Venglustat』は脳内に到達する特性を有し、神経症状の改善が期待されています。
↧
厚生労働省の中央社会保険医療協議会(中医協)は8月22日、去る7月3日と8月3日に承認された、新規・新有効成分含有医薬品で、これまで販売されていない新薬9製品の薬価収載を了承しました。
これらは8月29日に収載されます。その中で、国内初となる、レボノルゲストレルを含む月経困難症治療薬「ジェミーナ®配合錠(一般名:レボノルゲストレル/エチニルエストラジオール配合製剤)」が、新たに薬価収載される。
「ジェミーナ®配合錠」は、ノーベルファーマ株式会社(本社:東京都中央区日本橋)が今年7月2日に製造販売承認を取得していた、「月経困難症」を効能・効果とする新医療用配合剤で、1錠当たりレボノルゲストレル(LNG=Levonorgestrel)を0.09mg、エチニルエストラジオール(EE=Ethynylestradiol)を0.02mgを含有する治療薬です。
本剤は月経困難症治療薬として、日本初のレボノルゲストレルを含有した“一相性超低用量エストロゲン・プロゲスチン配合製剤”となります。![月経困難症治療薬ジェミーナ配合錠]() レボノルゲストレル/エチニルエストラジオール配合製剤
レボノルゲストレル/エチニルエストラジオール配合製剤
月経困難症治療剤「ジェミーナ®配合錠」
(Jemina®tablets)
痛みは月経時、又は月経の1~3日前に起こる事があり、痛みは月経開始後24時間で最大となり、2~3日後に軽減する傾向があります。
痛みは多岐にわたり、下腹痛、腰痛、腹部膨満感、悪心・嘔吐、頭痛、いらいら感、脱力感、便秘または下痢、頻尿などが現れ、月経痛は多少でも痛みがあるものを含めると、女性の約80%に見られ、その約半数は、日常生活に支障をきたしているとの報告がある。
月経困難症の病因は、子宮内膜症など骨盤内に器質性病変のある『器質性月経困難症(続発性月経困難症)』と、子宮内膜に増加したプロスタグランジン(=痛みや炎症の原因となる生理活性物質)の関与が考えられる『機能性月経困難症(原発性月経困難症)』に大別される。
月経困難症の治療では、エストロゲン(E:卵胞ホルモン)とプロゲスチン(P:黄体ホルモン)との配合剤を使用することが第一選択となっている。
薬剤を長期間安全に使用するためには、エストロゲンの低用量化と共にプロゲスチンの薬剤選択が重要となり、日本国内で、月経困難症の適応を有する薬剤は、13製剤が販売されている。
そのうち、エストロゲン(卵胞ホルモン)の低用量化エチニルエストラジオール(EE=卵胞ホルモン)に、プロゲスチン(黄体ホルモン)としてドロスピレノン(DRSP)との配合製剤(ヤーズ配合錠)、プロゲスチンとしてノルエチステロンとの配合製剤(ルナベル配合錠)などの低用量エストロゲン・プロゲスチン(低用量EP)製剤が使用されています。
「ジェミーナ®配合錠」と既存の月経困難症治療薬2剤との成分比較
![月経困難症治療薬の成分比較]()
*レボノルゲストレル、ドロスピレノン、ノルエチステロンはいずれも合成黄体ホルモン。
「ジェミーナ®配合錠」は月経困難症の適応を持つ薬剤では最も低い用量となる。
これによって脳や肺の血栓症のリスク低減の可能性。
【販売名】:ジェミーナ配合錠
【一般名】:レボノルゲストレル/エチニルエストラジオール配合製剤
【有効成分・含量】:レボノルゲストレル(0.09mg)/日局エチニルエストラジオール(0.02mg)
【効能・効果】:月経困難症(避妊や子宮内膜症の適応はありません)
【用法・用量】:次のいずれかを選択する。
(1)21日間連続投与、7日間休薬の28日間を1周期とした投与方法。
(2)77日間連続投与、7日間休薬の84日間を1周期とした投与方法。
いずれの場合も出血の有無にかかわらず、1周期終了後の翌日から次の周期を開始し、以後同様に繰り返す、となっている。
用法・用量が14日を超える投与期間であること。
既存薬に於いて、14日を超える投薬の安全性は確認されている事から、例外として処方日数制限を14日ではなく30日とする事が提案され、中央社会保険医療協議会総会で了承された。
◆同一成分を配合した製剤としては、3相性の経口避妊薬(低用量ピル=アンジュ/トリキュラー/ラベルフィーユ)が臨床使用されているが、薬価基準未収載で保険適応になっていない。
「ジェミーナ®配合錠」は、月経困難症に適応を有する低用量EP(黄体ホルモン・卵胞ホルモン混合)製剤の中でも、EE(エチニルエストラジオール=卵胞ホルモン)含量が最も低い用量(0.02mg)と同一で、プロゲスチン(黄体ホルモン)としてLNG(レボノルゲストレル)を配合した事が特徴である。
海外での研究結果から、レボノルゲストレル含有のEP製剤は、黄体ホルモンとしてドロスピレノン含有のEP製剤よりも血栓症の発症リスクが低いことが確認されている。
また、EP(黄体ホルモン・卵胞ホルモン混合)製剤の連続投与は、28日周期投与に比べて(84日周期の方が)月経回数を減らす事により、疼痛軽減が期待されること。一方、28日周期投与では連続投与に比べて破綻出血の発生が少ない事もあり、「ジェミーナ®配合錠」はいずれの投与方法も選択可能なEP製剤となっている。本剤はノーベルファーマ株式会社と、あすか製薬株式会社(本社:東京都港区芝浦)で販売提携をしており、今後、両社医薬情報担当者を通じて、本剤の適正使用に関する情報提供に努めるとコメントしている。
↧
September 5, 2018, 9:18 am
厚生労働省の薬事・食品衛生審議会 医薬品第二部会は8月29日、アステラス製薬株式会社(本社:東京都中央区日本橋)が、本年3月23日、 世界で初めて、日本で製造販売承認を申請していた、世界初のFLT3/AXL阻害剤の「再発または難治性のFLT3遺伝子変異陽性の急性骨髄性白血病」を効能・効果とする「ゾスパタ錠40mg(一般名:ギルテリチニブフマル酸塩、開発コード:ASP2215)」について、新有効成分含有医薬品・希少疾病用医薬品・先駆け審査指定医薬品として、承認を了承した。
本剤は、「成人の再発/難治性FLT3(FMS-like tyrosine kinase 3)遺伝子変異陽性急性骨髄性白血病」の治療薬として3月29日に、米国に於いても同様の対象疾患で、米国食品医薬品局(FDA)に製造販売承認申請を行っている。
今回、申請から5ヶ月余りで、日本で最初に迅速承認が了承された事で、9月下旬にも正式承認となる見通しである。![写真はイメージ]() *写真はイメージです。
*写真はイメージです。
FLT3遺伝子変異陽性の急性骨髄性白血病治療薬「ゾスパタ錠40mg(ギルテリチニブ)」は、
製造販売承認が了承されましたが、まだ製品写真はありません。
国内で罹患者が最も多いのは「急性骨髄性白血病」で、白血病全体の約6割を占め、成人の白血病では最も多いタイプです。
急性骨髄性白血病(AML=Acute Myeloid Leukemia)は、どの年齢層でも見られますが、時には、別の癌の治療で行った化学療法や放射線療法により、急性骨髄性白血病になる事があります。
急性骨髄性白血病は、加齢と共に患者数が増加し、国内では毎年約5500人が新たに急性骨髄性白血病と診断されています。そのうちFLT3遺伝子変異陽性の患者は約2100人で、そのうち再発または難治性は更に限定される希少疾病です。
急性骨髄性白血病では、骨髄で作られる未熟な白血球が、本来なら好中球→好塩基球→好酸球→単球に成長する細胞が、癌化し骨髄に蓄積して、短期間で正常な血球を作る細胞を破壊する事で発症します。
白血病細胞は血流に乗って他の臓器に運ばれ、頭痛、嘔吐、視力障害、聴力障害、顔の筋肉の異常(白血病性髄膜炎)を引き起こし、時に脳と脊髄を覆う組織(髄膜)に広がる事があります。
〔引用元:MSD(株)マニュアル家庭版:血液の病気/白血病/急性骨髄性白血病(AML、急性骨髄芽球性白血病、急性骨髄単球性白血病、急性骨髄球性白血病)より〕
急性骨髄性白血病の発症原因については、サブタイプの1つである「急性前骨髄性白血病」に於いて、前骨髄球(成熟した好中球へと成長する初期段階の細胞=分化能力が低下した骨髄球)が染色体変異を起こし、これらの未熟な細胞が蓄積される事ですが、異常となる起因の一因が遺伝子変異で、同定された遺伝子は、KIT、FLT3、NPM1、CEBPA、RAS、WT1、BAALC、ERG、MN1、DNMT、TET2、IDH、ASXL1、PTPN11、CBL及びAXLで、これらが複雑に絡み合って、腫瘍細胞の増殖、癌細胞DNAの分裂速度、薬剤耐性、非治療反応や再発に関わっている、と考えられています。
〔引用元:MSD(株)マニュアル家庭版:血液の病気/白血病/急性骨髄性白血病、2017米国医学図書館/国立衛生研究所 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5767295/〕急性骨髄性白血病は、治療をしない場合、一般に診断後数週間から数カ月で死に至ります。
治療によって、20~40%の患者が再発せずに5年以上生存できます。
再発は、ほぼ必ず最初の治療から5年以内に起こるため、5年を過ぎても白血病が再発しない場合は治癒したと考えられます。
また、化学療法による治療効果が見られない場合や、寛解には至ったものの再発の可能性が高い(一般に、特定の染色体異常が認められている場合)と考えられる若い人では、化学療法薬の大量投与に続けて、幹細胞移植が行われますが、実施できない再発患者では治療の選択肢が限られてきます。「ゾスパタ錠」は、癌細胞の増殖に関与する受容体型チロシンキナーゼ(細胞内シグナル伝達酵素の総称)であるFLT3及びAXL(癌細胞膜に発現)を阻害する事で、急性骨髄性白血病の患者の約33.3%で認められる活性化変異(=遺伝子内縦列重複変異(ITD:Internal Tandem Duplication)と、 チロシンキナーゼドメイン変異(TKD: Tyrosine Kinase Domain)FLT3を共に抑制し、癌細胞の増殖を阻止します。
〔急性骨髄性白血病 - 遺伝的変化及びその臨床予後 2017 Oct 1; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5767295/(米国医学図書館/国立衛生研究所)〕
「ゾスパタ錠40mg(ギルテリチニブ フマル酸塩)」が標的とするFLT3タンパク質は、第13番染色体q12.2に存在する遺伝子が作る、細胞表面のシグナルを細胞内部に伝達するタンパク質の一つです。
FLT3受容体型チロシンキナーゼは、信号形質導入と呼ばれるプロセスによって、細胞内部に細胞表面からの信号を送りますが、このFLT3遺伝子変異によって、未熟な白血球が増殖し、癌化する事で白血病を発症します。
〔全国バイオテクノロジー情報(米国医学図書館)センター/ゲノム情報装飾ページより〕同剤は、腫瘍の増殖に関与するFLT3を介したシグナル伝達を阻害して、更に、AXLの介在による薬剤耐性を阻止する事で、腫瘍の増殖と逃避を抑制すると考えられている。
本剤は1日1回120mgを経口投与する。
FLT3を単独で阻害する薬剤は欧州で承認されているが、本剤のようにFLT3/AXLを同時に標的とした薬剤は、海外ではまだ承認されていない。AXL遺伝子は、第19番染色体に存在する形質転換遺伝子で、近年の研究で、このAXLが作り出すタンパク質(酵素)が、ヒトの免疫細胞から癌細胞を逃避させ、抗がん剤に対する薬物耐性を促進させる因子として浮上し、予後不良の癌へと変化させる事が分かって来た。
〔引用元:腫瘍細胞の可塑性および治療抵抗性におけるAXL受容体チロシンキナーゼの役割<2017,腫瘍微小環境のバイオマーカーの研究:Davidsen、KjerstiT。 Haaland、Gry S。 Lie、Maria K。 Lorens、James B.(ISBN 978-3-319-39147-2)〕
![急性骨髄性白血病のAXL蛋白受容体の信号伝達を阻害]() AXL遺伝子が発するシグナルは、第一選択抗がん剤の特徴を記憶し、
AXL遺伝子が発するシグナルは、第一選択抗がん剤の特徴を記憶し、
再発時の癌細胞の治療抵抗性を生み出し
癌細胞の生存率と転移を増幅する役割を担っていると考えられている。
癌細胞のDNAを攻撃する事がこれまでの抗がん剤だったが、新たに
(同時に)AXLの働きを阻止する事で治療成績の向上が期待される。
AXLの活動増加は、肺癌、乳癌、膵臓癌、卵巣癌、結腸癌、及び悪性黒色腫を含む多数の癌に関連しており、特に生存率の低い癌と強い相関がある事が示されている。
〔https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1501169/肺腺癌におけるAxlの発現および腫瘍進行との相関(PMC1501169:2005年12月7日==米国医学図書館/国立衛生研究所)〕
腫瘍微小環境で合図(シグナル発信)しているAXLは、複数のメカニズムによって腫瘍進行を進めます。
腫瘍と間質独房で合図しているAXLは、免疫抑制、ガン幹細胞表現型、治療に対する抵抗、増殖、上皮間葉転換(EMT)、転移とアポトーシスに対する抵抗を促進する事ができると考えられている。
〔米国国立医学図書館/テヘラン医科大学血液学及び腫瘍学、幹細胞研究 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5767295/〕
↧
↧
September 12, 2018, 7:29 am
8月初旬、治験開発業務受託会社 株式会社クロエ(本社:東京都豊島区南池袋)と、アストラゼネカ株式会社(本社:大阪府大阪市北区)、それに近畿大学医学部内科学腫瘍内科部門 主任教授:中川和彦先生監修のもと、『進行・再発非小細胞肺がん』患者を対象とした、薬剤治療に関する意識調査を実施し、その調査結果を公表しました。 Ⅰ.)がんの薬剤治療に最も期待している事は?- 治療中の薬剤の効果が長く続くこと【86%】
- 副作用による負担が少ないこと【11%】
- 治療費が高すぎないこと【2%】
- その他【1%】
Ⅱ.)治療中に安心する時は?(複数回答)- 検査結果で異常が無かった時【95%】
- 薬の効果を実感できた時【77%】
- 副作用が感じられない時【70%】
- 趣味ができている時【59%】
- 家事ができている時【50%】
- 仕事ができている時【47%】
- 仲間や友人と話している時【31%】
- 周りの人が理解を示してくれた時【30%】
- 自分の悩みを聞いてもらえた時【29%】
Ⅲ.)避けたい副作用は?- 吐き気・嘔吐【30%】
- 脱毛【24%】
- (白血球数/好中球数など)検査値異常【11%】
- 食欲不振【8%】
- 下痢【6%】
- 身体がだるい【5%】
Ⅳ.)初めて薬剤治療を開始する前の治療に対する不安は?(複数回答上位4つ)- 効果が長続きするのかと言う不安【57%】
- 副作用で辛い治療になるのではと不安【53%】
- 通院回数・時間が多くなる【29%】
- 治療費の不安【24%】
<調査対象者>
Ⅴ.)EGFR遺伝子変異- 陽性【54%】
- 陰性【35%】
- 不明【11%】
Ⅵ.)病勢- 進行【82%】
- 再発【18%】
Ⅶ.)一番最初の薬剤治療開始時、医師等から受けた説明は?(複数回答)- 薬剤について【88%】
- 肺がんのタイプ【88%】
- 病期(ステージ)【83%】
- 遺伝子変異検査の結果【82%】
- 転移部位【71%】
- 入院等の手続き【57%】
- 今後の生活【33%】
- 予後【25%】
- 治療の費用【19%】
Ⅶ-a.)薬剤について…どんな説明を受けたか?(複数回答)- 副作用の説明【97%】
- 投与方法について【95%】
- 分子標的薬と抗がん剤があること【82%】
- 遺伝子変異について【66%】
- どのくらいの期間、効果が続くか【51%】
- 最初の薬剤が効かなくなった【27%】
- 使える薬剤が無くなった【9%】
▼非小細胞肺癌(NSCLC)患者定量調査 Report
https://www.astrazeneca.co.jp/content/dam/az-jp/press-releases/pdf/20180808.pdf進行・再発非小細胞肺がんは、昨今の治療選択肢の増加に伴い複雑化しています。
メディアに取り上げられる薬剤がある反面、効果が限定的であったり、進行・再発の非小細胞肺がんには使用できない薬剤もあります。
特に、ステージⅢ、ステージⅣの場合、治療薬の選択にあたっては、多角的な検討が必要となります。
また、薬剤治療を初めて経験する患者については、治療に対する期待や不安が様々であると想定される事から、患者の心情を理解したうえで、ベストな治療を選択する必要性が高まっています。
今回の調査結果から、進行・再発非小細胞肺がん患者では、診断後、初めて薬剤治療を開始する際に、高い治療効果と忍容性(薬剤の副作用に耐えられるか)が、より長く維持する安定した治療薬を望むことが明らかとなった。(すなわち再発を阻止する薬剤の登場への期待)
寛解や長期延命だけでなく、副作用の軽微な薬剤も益々、求められる時代となっています。
そういう薬剤は、患者の声があって初めて創薬されるものなので、治療中であってもどんどん声に出して言う事が重要です。
↧
September 17, 2018, 9:21 am
アストラゼネカ株式会社(本社:大阪府大阪市北区)は8月29日、「切除不能な局所進行の非小細胞肺癌(NSCLC)における根治的化学放射線療法後の維持療法」を効能・効果とした『イミフィンジ®点滴静注120mg、同500mg(一般名:デュルバルマブ(遺伝子組換え)』の販売を開始したと発表しました。
「イミフィンジ®点滴静注」は、切除不能(手術適応外)な局所進行(ステージIII)非小細胞肺がん(NSCLC)に対する治療薬として承認された、国内初の抗PD-L1ヒトモノクローナル抗体(抗PD-L1抗体/がん免疫療法薬)です。![非小細胞肺癌治療薬イミフィンジ点滴静注-デュルバルマブ]() 「切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法」剤
「切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法」剤
『イミフィンジ®点滴静注120mg、イミフィンジ®点滴静注500mg」
<切除不能な局所進行(ステージⅢ)非小細胞肺がん(NSCLC)に対する治療薬>
*癌が他の臓器に転移したステージIVとは区別されます。
ステージIIIの非小細胞肺がんの患者数は、日本国内では非小細胞肺がん全体の約20%を占めており、肺がん全体の年間死亡者数は7万7300人で、癌の中で第1位となっている。〔公益財団法人 がん研究振興財団「がんの統計’17」/2016年がん統計予測・国立がん研究センター〕
![非小細胞肺癌のステージ3病気の治療方法]() 非小細胞肺癌ステージⅢ期治療法
非小細胞肺癌ステージⅢ期治療法
ステージIIIは、局所コントロールと遠隔転移抑制によって根治が目標となる最後の病期です。
しかし、多くの場合が切除不能で、根治的化学放射線療法(根治的CRTとは=化学療法と放射線療法の併用)の適応となっていますが、根治的化学放射線療法を行っても、89%は病勢が進行、又は転移しており、5年生存率は15%と極めて低い。〔Aupérin A, et al 2010; 28(13):2181-90/全米バイオテクノロジー情報センター◇https://www.ncbi.nlm.nih.gov/pubmed/20351327〕
現在の標準治療は、根治的化学放射線療法(根治的CRT)後の無治療経過観察に留まることから、新たな治療方法や治療薬の登場が強く望まれていました。アストラゼネカ株式会社によると「イミフィンジ®点滴静注」は、ステージIII非小細胞肺がん治療では、日本で最初の抗PD-L1抗体となる。
同じ抗PD-L1抗体薬で、がん免疫療法で非小細胞肺がんの適応を持つ「オプジーボ(小野薬品)」、「キイトルーダ(MSD)」、「テセントリク(中外製薬)」はいずれも、切除不能な進行・再発のケースを適応としているが、「イミフィンジ®点滴静注」は、局所進行の根治的化学放射線療法(CRT)後の維持療法と、他剤と適応が異なっている。肺がん治療は、近年、がん免疫療法‥‥特に、非特異的免疫調節制御因子に抑制的に作用する『免疫チェックポイント阻害剤』の登場で、治療に大きな変化がもたらされました。
免疫チェックポイント阻害剤とは――
癌細胞が、体内の免疫システムにブレーキを掛けて逃れる為に、免疫細胞(T細胞やNK細胞など)に活動の抑止を働きかけるシグナルを送っていますが、このシグナル伝達を「薬剤」によって阻害し、免疫細胞の活動を活発化させ、癌細胞を消滅させる薬剤の事です。
標的となるシグナル伝達の発信元が、PD-1とPD-L1や、CTLA-4などの細胞表面に発現する抗原で、PD-1(プログラム細胞死1=Programmed cell Death-1)と、PD-L1(プログラム細胞死リガンド1=Programmed cell Death Ligand-1)、それにCTLA-4(細胞傷害性Tリンパ球関連抗原4)などのT細胞表面分子を介した経路を、選択的に阻害する事で、効果を発揮します。
従って、免疫療法と言っても、体内の免疫力をアップするのではなく、癌細胞が持つT細胞などから逃避する能力を奪う事で、体内の免疫細胞の働きを援護する薬剤を意味する。「イミフィンジ®点滴静注(Durvalumab/Imfinzi®)」は、アテゾリズマブ(商品名:テセントリク)と同じようにPD-L1に結合し、PD-L1とその受容体であるPD-1の相互作用を阻害する、切除不能な局所進行非小細胞肺がん治療薬として承認された、ステージⅢの適応を有する国内初の抗PD-L1ヒトモノクローナル抗体(抗PD-L1抗体)です。
「イミフィンジ®」は、PD-L1に結合し、その受容体であるPD-1と、更にCD80とCTLA-4の相互作用をも阻害する事で、癌細胞の免疫逃避機構を抑制し、T細胞の抗腫瘍免疫反応を増強します。【製品概要】
【製品名】:イミフィンジ®点滴静注120mg、イミフィンジ®点滴静注500mg(Imfinzi®)
【一般名】:デュルバルマブ(Durvalumab=遺伝子組換え)
【効能・効果】:切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法
【用法・用量】:通常、成人にはデュルバルマブ(遺伝子組換え)として、1回10mg/kg(体重)を2週間間隔で60分間以上かけて点滴静注する。但し、投与期間は12ヵ月間までとする。
【薬価】:
120mg1バイアル 112,938円
500mg1バイアル 458,750円
尚、「がん細胞が免疫にブレーキをかける」仕組みに働きかけ、解除するような『免疫チェックポイント阻害剤』は、一部の薬剤に限られ、他のチロシンキナーゼ阻害剤などとの併用療法が推奨されています。
また、治療効果が認められる癌の種類も今はまだ限られており、ほとんどの免疫療法(広義)は研究開発中です。
現在、効果が明らかにされ、診療ガイドラインに記載されて、標準治療となっている治療方法は、1,)体内の免疫(T細胞など)の活性化を持続する(=ブレーキが掛かるのを防ぐ)方法。2,)体内の免疫を強める(アクセルを強める)方法の一部に限られます。
↧
September 24, 2018, 2:57 am
厚生労働省は9月18日、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第4条の第5項第3号の規定」に基づく要指導医薬品である、以下の医薬品について、平成30年9月17日をもって、医薬品・医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則第7条の2、第1項2号に定める期間を満了したため、本年9月18日より、『要指導医薬品から一般用医薬品(第一類医薬品)に移行することなりました。
これに伴い、<中略>厚生労働大臣が指定する要指導医薬品の一部を改正する件が、平成30年9月18日に告示され、同日から適用されます。(改正告示)【要指導医薬品から第一類医薬品に移行する医薬品】
【有効成分】:フッ化ナトリウム(洗口液に限る)
【第一類医薬品となる日】:平成30年9月18日◆ 販売名『エフコート』(サンスター)
◆ 販売名『クリニカ フッ素メディカルコート』(ライオン)![エフコート]() エフコート(2味あり/サンスター)
エフコート(2味あり/サンスター)
2018年5月31日までにモニター薬局262軒から報告された1195例のうち、副作用の報告はなかった。
一般調査では、副作用が35例38件報告されたが、いずれも重篤ではなく、口内・舌・口唇のピリピリ感(7件)、口渇(3件)、歯の変色・着色(2件)、味覚異常(2件)など。
「エフコート」は、誤飲によるフッ化物洗口液での有害事象が懸念されていた。今回の調査では12例が「使用中に誤飲した」と、回答していたが、いずれも「洗口(ブクブクうがい)が出来ましたか」の質問に、「はい」と回答しており、有害事象の報告もなかった。
![クリニカ_フッ素メディカルコート]() クリニカ フッ素メディカルコート(ライオン)
クリニカ フッ素メディカルコート(ライオン)
◎「クリニカ フッ素メディカルコート」は、2017年6月2日に要指導医薬品として承認、同年9月27日に製造販売を開始した。
2018年4月13日までにモニター薬局216軒から371例が報告があり、このうち副作用は4例あったが、いずれも重篤ではなく、適用部位刺激感(2件)、舌の感覚鈍麻(1件)、下痢(1件)だった。
一般調査では、副作用6例6件報告されたが、こちらも重篤ではなかった。使用中の誤飲は3例認められたが、洗口はできた旨の回答があり、有害事象の申し出報告はなかった。
この結果を受け、厚生労働省の薬事・食品衛生審議会 医薬品等安全対策部会安全対策調査会は、2018年8月28日、『フッ化ナトリウム洗口液』を要指導から第1類に移行して差し支えないと判断。医薬品等安全対策部会の承認を経て、今回の告示に至った。【要指導医薬品とは‥‥】
薬剤師による対面での情報提供、及び指導が必要であると義務付けられ、インターネット販売が原則禁止とされている医薬品のこと。
「スイッチOTC(スイッチ直後品)」と毒劇薬が該当する。OTC医薬品のうち、一般用に転用されて間もないため、リスクに関する評価が不十分な医薬品のことで、スイッチOTCは市販後原則3年(市販第四相臨床試験)の間、安全性評価が行われる。【告示】https://www.mhlw.go.jp/hourei/doc/tsuchi/T180918I0010.pdf
↧
シャイアー・ジャパン株式会社(本社:東京都千代田区丸の内)は9月21日、国指定難病の一つの「遺伝性血管性浮腫(HAE=Hereditary Angioedema)」の治療薬、選択的ブラジキニンB2受容体ブロッカー「フィラジル®皮下注30㎎シリンジ(一般名:イカチバント酢酸塩=米:FIRAZYR®)」について、厚生労働省より『遺伝性血管性浮腫の急性発作』を効能・効果として、製造販売承認を取得したと発表しました。
「フィラジル®皮下注30㎎シリンジ」は、発作の原因である*ブラジキニン(↓)の作用を直接的に阻害する、唯一の遺伝性血管性浮腫(HAE)治療薬となります。![フィラジル皮下注30㎎シリンジ_HAE治療薬]() 選択的ブラジキニンB2受容体ブロッカー
選択的ブラジキニンB2受容体ブロッカー
遺伝性血管性浮腫治療薬「フィラジル®皮下注30㎎シリンジ」
遺伝性血管性浮腫の症状は、突然顔や唇、手足、消化器などさまざまな部位に腫れやむくみ、激しい痛みが起きる疾患です。
遺伝性血管性浮腫の患者は、身動きが出来ないほどの激しい腹痛に襲われたり、唇や顔がヒドく腫れて変形し、別人のように変貌してしまう発作を起こします。
浮腫の症状は2~5日間程度で治まる事が多いものの、慢性的に繰り返す疾患です。
罹患率は5万人に1人の割合で、国内の患者数は推定2,500人ですが、実際に治療している患者は約450人にとどまると言われています。
急性発作時に最も 深刻なのは、顔面の腫れが喉頭(のど)に及んだ場合、呼吸困難や窒息を起こし、死亡する危険もあり、発作時は出来る限り早く治療する事が推奨されている。
しかし、学校や職場で発作が起きた場合、多くの患者にとってその場を離れて速やかに医療機関を受診する事は容易ではありません。
また、夜間に発症した場合には、その場で早期に治療できる選択肢が存在しない為、翌朝まで自宅で我慢を強いられている患者も少なくありません。
![遺伝性血管性浮腫の気道狭窄発作の前と後]() 遺伝性血管性浮腫の気道狭窄発作(上A図)
遺伝性血管性浮腫の気道狭窄発作(上A図)
内視鏡による拡張処置後(下B図)
このように、遺伝性血管性浮腫の患者は、日常生活に於いて、様々な支障があり大きな負担となっており、「早期治療」「早期処置」は、現在の日本の遺伝性血管性浮腫治療の最大のアンメットニーズ(疾患に対する治療法がQOL改善に至っていない)として認識されています。 *ブラジキニンとは‥‥。
血管拡張や痛み刺激の伝達などの生理作用を持つ血液中に存在する生理活性物質。「遺伝性血管性浮腫の急性発作」は、C1インヒビターの欠損、又は機能障害によって過剰に産生されたブラジキニンが、その受容体であるB2受容体に結合して、血管透過性が亢進(=強める)する事で引き起こされます。
![遺伝性血管性浮腫治療薬フィラジルの作用機序]() 遺伝性血管性浮腫の急性発作の仕組みと
遺伝性血管性浮腫の急性発作の仕組みと
「フィラジル®皮下注30㎎シリンジ(イカチバント)」の作用機序
「フィラジル®皮下注30㎎シリンジ」は、HAE発作の原因である“ブラジキニンの作用を直接的に阻害する唯一の治療薬”です。
また本剤は、面倒な投与前の準備が不要で、針を装着した後、直ちに投与出来るように、ブラジキニンの作用を直接的に阻害する有効成分を注射器内に予め充填しており(プレフィルドシリンジ製剤)、煩雑な投与前の準備も不要で、速やかな治療(腹部への自己皮下注)が可能な唯一のHAE治療薬でもあります。
更に本剤は、一回の注射で速やかにHAEの発作症状を緩和させる事が期待できる事で、HAE患者に新たな治療の選択肢を提供し、早期治療を通じ、患者のQOL改善に貢献できると期待されます。
本剤は、欧州で2008年に最初の承認を受けた後、既に世界45カ国で承認、販売されています。【製品概要】
【製品名】:フィラジル®皮下注30㎎シリンジ(FIRAZYR®pre-filled syringe)
【一般名】:イカチバント酢酸塩(Icatibant injection)
【効能・効果】:遺伝性血管性浮腫の急性発作
【薬理作用】:選択的ブラジキニンB2受容体ブロッカー
<有効性について>
◆国内第III相臨床試験に於いて、皮膚、腹部、又は喉頭(のど)に発作を生じた患者計8名に本剤を投与(うち3名は自己投与)した症例で、症状緩和までの時間の中央値は、約1時間45分で、全患者では投与後5時間以内に症状が緩和した。
◆また、発作の発現から1時間未満に本剤を投与した群では、1時間以上経過後に投与した群と比べ、発作持続時間の有意な短縮が見られた。
↧
↧
社会保険診療報酬支払基金(本部:東京都港区新橋)は9月28日、添付文書記載の効能・効果や用法・用量以外でも、審査上認める使用例として5事例を追加する事を公表しました。Press release ;; http://www.ssk.or.jp/shinryohoshu/teikyojirei/new_jirei/index.files/300928_19_ika.pdf【第19次審査情報提供事例(医科/核医)】
新たに追加されたのは、次の医薬品における、以下の使用例。
①<一般名:ドキシサイクリン塩酸塩水和物(DOXY)>
<商品名:ビブラマイシン(錠剤)>
<適応菌種>ドキシサイクリンに感性のブドウ球菌属、レンサ球菌属、肺炎球菌、淋菌、炭疽菌、大腸菌、赤痢菌、肺炎桿菌、ペスト菌、コレラ菌、ブルセラ属、Q熱リケッチア( コクシエラ・ブルネティ)、クラミジア属
<適応症>
表在性皮膚感染症、深在性皮膚感染症、リンパ管・リンパ節炎、慢性膿皮症、外傷・熱傷及び手術創等の二次感染、乳腺炎、骨髄炎、咽頭・喉頭炎、扁桃炎、急性気管支炎、肺炎、慢性呼吸器病変の二次感染、膀胱炎、腎盂腎炎、前立腺炎(急性症、慢性症)、尿道炎、淋菌感染症、感染性腸炎、コレラ、子宮内感染、子宮付属器炎、眼瞼膿瘍、涙嚢炎、麦粒腫、角膜炎(角膜潰瘍を含む)、中耳炎、副鼻腔炎、歯冠周囲炎、化膿性唾液腺炎、猩紅熱、炭疽、ブルセラ症、ペスト、Q熱、オウム病
<適応追加症例>
ざ瘡(ニキビ=化膿性炎症を伴うもの)に対して処方された場合に、日本皮膚科学会の「尋常性座瘡(ざそう)治療ガイドライン2017」などを踏まえて、審査上認めるとする。 ②<一般名:放射性医薬品基準 人血清アルブミン・ジエチレントリアミン・五酢酸テクネチウム(99mTC)注射液>
<商品名:プールシンチ注>
<適応使用>
各種臓器・部位の血行動態及び血管性病変の診断。
<適応追加症例>
原則として、本剤を「リンパ浮腫」に対して投与した場合、当該使用事例を審査上認める。
但し、用法・用量は、投与部位1箇所あたり、約40~80MBq(メガベクレル)を容量が0.1~0.2mL以内となるように調製の上、皮膚内に投与しシンチグラムを得ること。【第19次審査情報提供事例(歯科)】
③<一般名:アモキシシリン水和物・クラブラン酸カリウム(AMPC・CVA)>
<商品名:オーグメンチン配合錠 125SS, 250RS/クラバモックス小児用配合ドライシロップ1.01g>
<適応菌種>
本剤に感性のブドウ球菌属、淋菌、大腸菌、クレブシエラ属、プロテウス属、インフルエンザ菌、バクテロイデス属、プレボテラ属(プレボテラ・ビビアを除く)
<適応症>
表在性皮膚感染症、深在性皮膚感染症、リンパ管・リンパ節炎、慢性膿皮症、咽頭・喉頭炎、扁桃炎、急性気管支炎、慢性呼吸器病変の二次感染、膀胱炎、腎盂腎炎、淋菌感染症、子宮内感染、子宮付付属炎、中耳炎
<適応菌種>
本剤に感性の肺炎球菌(ペニシリンGに対するMIC≦ 2μg/mL)、モラクセラ(ブランハメラ)・カタラーリス、インフルエンザ菌、ブドウ球菌属、大腸菌、クレブシエラ属、プロテウス属、バクテロイデス属、プレボテラ属(プレボテラ・ビビアを除く)
<適応症>
表在性皮膚感染症、深在性皮膚感染症、リンパ管・リンパ節炎、慢性膿皮症、咽頭・喉頭炎、扁桃炎、急性気管支炎、膀胱炎、腎盂腎炎、中耳炎、副鼻腔炎
<適応追加症例>原則として、「アモキシシリン水和物(内服薬)・クラブラン酸カリウム」を「歯周組織炎」、「歯冠周囲炎」、「顎炎」に対して処方した場合、使用事例を審査上認める。 ④<一般名:プロポフォール(注射薬/歯科麻酔)>
<商品名:1%ディプリバン注200mg/20mL、500mg/50m L、1g/100mL、1%ディプリバン注キット200mg/20 mL、500mg/50mL><適応症>
全身麻酔の導入及び維持、及び集中治療に於ける人工呼吸中の鎮静
<適応追加症例>
原則として、「プロポフォール(注射薬)」を、「歯科・口腔外科領域に於ける手術、又は処置時等の鎮静」を目的に静脈内鎮静法で使用した場合、当該使用事例を審査上認める。
但し、留意事項を遵守して使用した場合に限る。
又、本使用例は、成人の患者に認める。(高齢者を含む)
<留意事項>
歯科・口腔外科領域に於ける手術又は処置時等の鎮静として、新たに追加された留意事項を遵守する。 ⑤<一般名:アモキサピン(三環系=内服薬)>
<商品名:アモキサンカプセル10㎎、25㎎、50㎎、アモキサン細粒10%>
<適応症>
うつ病・うつ状態
<適応追加症例>原則として、「アモキサピン」を「*逆行性射精症」に対して処方した場合、当該使用事例を審査上認める。*逆行性射精症は…
射精時に陰茎から射出される精液量が減るか、もしくは全く射出されずに、膀胱に逆流する症状を言います。原因は様々ですが、オルガスムは得られ、通常は治療の必要はなく、身体に害はありません。逆流した精液は尿と一緒に排出されます。
しかし、妊孕(にんよう)は難しく、不妊症の原因になる事もあり、子供を希望する場合は医師の指導のもと、不妊治療が必要です。
今回の添付文書記載以外でも診療報酬該当例と認める上で、社会保険診療報酬支払基金は、留意事項として――
①と③の抗菌薬使用に際し、急性炎症期の中等症以上の症状に対して用い、急性炎症期は約3カ月を目安とすること、炎症軽快後は、抗菌薬を中止しアダパレン(ディフェリン他)や過酸化ベンゾイル(ベピオ他)などの薬剤耐性菌の懸念のない薬剤を用いた維持療法に移行すること――などを挙げている。
↧
October 14, 2018, 9:23 am
乳腺の元々の姿。 ★女性の乳腺だけが発達する理由。乳腺は汗腺(皮膚腺の一種)が変形したものです。
哺乳類では皮膚に小汗腺(エクリン腺)、大汗腺(アポクリン腺)、皮脂腺、乳腺の四つの皮膚腺が出現します。小汗腺(普通の汗を分泌)は全身に分布し、水分の多い分泌物を出して(蒸発)、毛穴と共に体温調節に重要な働きをしています。
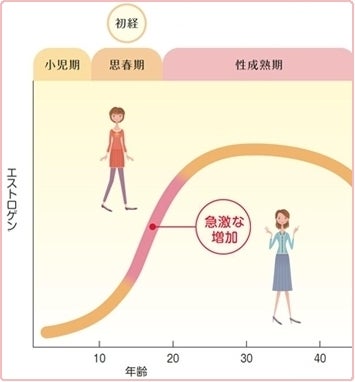
大汗腺(腋の下・まつ毛・外耳道・肛門の周囲・外陰部等に限る)は、やや粘りのある液を分泌しますが、乳腺(メロクリン汗腺)は大汗腺と同じ分泌様式です。 ▲尚、Web検索や一部のネット記事に於いて「乳腺はホロクリン分泌である」との記載がありますが、解剖医学用語集meddicに於いて=メロクリン腺とホロクリン腺(皮脂腺)は明確に区別されています。<参考元:米国テキサス州オースティン・コミュニティ大学解剖学分野「外皮の汗腺システム」図解説より>思春期前の子供たちでは、男性と女性の胸の一般的な構造は類似していて、女性の胸はエストロゲン(卵胞ホルモン)と黄体ホルモンの影響を受けて、思春期(二次性徴と言われる12歳頃~17歳頃)の間に大きくなり始めます。
![女性の思春期と二次性徴]() 女性の思春期のエストロゲン量の変化(二次性徴)
女性の思春期のエストロゲン量の変化(二次性徴)
女性の乳房は、性的成熟と共に発達し、更に妊娠により著しく発達して、母乳の産生と分泌が可能になります。
この母乳を産生する場所が「乳腺」と呼ばれる外分泌腺です。
「乳腺」は、ヒトを含む脊椎動物の哺乳類だけに存在し、この構造は、緻密な結合組織と豊富な脂肪組織に周囲を包まれた、乳腺房・乳腺小葉・乳腺葉の集合体です。
乳腺葉(lobus)は15~20個の乳腺小葉(lobulus)から成り、1個の乳腺葉からは1本の乳管(細乳管)が出ていて、それぞれが乳頭(乳首)開口部に至るまでに合流し、最終的に平均9本の乳管口が乳頭に開いています。![乳腺の腺房細胞]() 乳腺の腺房細胞《クリックで拡大します》
乳腺の腺房細胞《クリックで拡大します》
初乳も成熟乳も、全て母親の血液から作られます。 ◆初乳:乳房が最初に作る母乳です。濃縮した非常に栄養価が高い母乳で、色は濃黄色からオレンジ色ですが、人によって色合いにバラツキがあります。
このオレンジ色は高濃度のベータ(β)-カロチン(ビタミンAの元)の色で、母親の野菜の摂取量で色が違ってきます。
◆移行性乳:初乳後は高カロリーが必要になるため、脂肪や高栄養の移行性初乳が作られ始めます。それに伴って淡黄色から白色へと変わります。
脂肪分がまだ微量なため、移行性乳の段階で、母乳がやや青み色をしてる場合がありますが、この色は緑色の野菜の色素で、脂肪分が授乳によって増えるとクリーム色や乳白色に変化するので、心配はいりません。
◆成熟乳:初乳から約2週後、母乳は成熟した乳白色になります。初乳には脂肪分が殆ど含まれていません。それには理由がありますが、後述します*。
◆後期乳:この時期は安定した淡いクリーム色となります。さて、母親の食事で微妙に母乳の色に変化はあるものの、では何故、赤い血液から産生される母乳が、赤くないのでしょうか?実はそこには、産まれたばかりの赤ちゃんを守る為の、幾つもの巧妙な仕組みがあります。
そして先ほど触れた、初乳に脂肪分が殆ど含まれていない理由と関係して来ます。出産前…赤ちゃんは、母親のお腹の中では「無菌」の子宮内環境で育(はぐく)まれていますが、出産後は幾種の病原体が存在する子宮外環境にさらされるので、生存する為には免疫物質が必要です。(カビの胞子、ノミ、ダニ(死骸浮遊含む)、シラミ、花粉、コアクラーゼ陰性菌=皮膚常在菌、サルモネラ菌、狂犬病菌、大腸菌、インフルエンザウイルス等々)
それら病原菌や雑菌から守ってくれる免疫物質が、母親の初乳に含まれる蛋白質(ラクトフェリン、分泌型免疫グロブリンIgA、オリゴ糖)です。
特にオリゴ糖は、実に90種類以上含まれ、これらの多くは中耳炎、呼吸器感染、胃腸炎などの感染症から赤ちゃんを守る役割を担っています。
免疫グロブリンの種類と血中濃度割合![免疫グロブリンの種類]()
また、生まれたばかりの赤ちゃんの腸内には細菌はいませんが、口や鼻から雑菌が侵入してきて、腸内に住み着いて来ますが、オリゴ糖は腸内環境バランスを守るビフィズス菌を増やす働きがあります。初乳が、赤ちゃんの免疫強化に深く関わっている事は、既に知られている事ですが、初乳が淡黄色である理由はそれだけではありません。
初乳には、ビタミンAやビタミンEと言った、「抗酸化物質」が豊富に含まれています。
何故「抗酸化物質」が初乳に豊富に含まれているのでしょう?
その理由が、赤い血液が黄白色に変わる理由です。初乳を産生する為に使われる血液は、新鮮な酸素を大量に含んだ『動脈血』です。
呼吸で取り入れられた酸素は、肺の中でガス交換によって動脈内に取り込まれ、心臓のポンプの力で全身の隅々まで新鮮な酸素を運びます。
運ばれた酸素(O2)は、細胞で新陳代謝などに使われた後は、二酸化炭素(CO2)として「静脈」の中に入り、肺のガス交換で呼吸によって体外に排出されます。
![乳房の血液循環・乳房の動脈と静脈図]() 乳房の血液循環/乳房の動脈と静脈図
乳房の血液循環/乳房の動脈と静脈図
しかし赤ちゃんは酸素の極めて低い子宮内(胎盤供給)から、いきなり酸素の豊富な外気にさらされると、酸素が過剰になる事で体内の正常な細胞を傷つけてしまう……いわゆる活性酸素となってしまいます。
活性酸素は、細胞を直接的、或いは間接的に傷つけ、老廃物を作り出します。
活性酸素によって体内が酸化する事を「抗酸化作用」と言い、赤ちゃんの成長にはマイナスとなります。
*ここに初乳に脂肪分が微量である理由があります。
ビタミンAやDなどは、脂肪に溶ける性質(脂溶性ビタミン)があるので、僅か4~5日ですが、濃度の高いビタミンA類を与える事が目標の初乳には、脂肪分は邪魔となります。
何より先に出産直後の赤ちゃんを守り、「抗酸化作用」を防ぐためビタミンA類が最優先されるという訳です。
このビタミンAやビタミンEは、母親が食事(サプリメント含む)で体内に摂取する事で、乳汁として分泌されます。〔参考文献及び引用元〕
◆独立行政法人 家畜改良センター「免疫のシステムと初乳」抗体の血中分布より
◆最新家畜臨床繁殖学より
◆小学館 日本大百科全書(ニッポニカ)・ヒトにおける乳腺より
◆へるす出版 よくわかる母乳育児・第2章/乳房の解剖、乳腺組織の発生と発達より血液が赤色をしているのは赤血球に含まれるヘモグロビンの色で、へモグロビンは鉄を含む色素(ヘム)とタンパク質(グロビン)とから成り、酸素を運搬する役目を担っています。
しかし産まれたばかりの赤ちゃんも、肺呼吸によって自力で必要な酸素を得るので、呼吸以外からの大量の酸素は必要なく、乳汁はヘモグロビン色素が取り除かれた状態となり、血液色の「赤」から黄色やオレンジ色の様な色になるのです。 乳腺の本当の役割とは…。▼無抵抗な赤ちゃんに「免疫グロブリン(特に初乳にはIgAが多い)」を供給する事で、免疫機能を立ち上げ強化する。
*初乳のIgAは消化酵素の影響を受けにくい。消化酵素の影響を受けるIgGは殆ど含まない。成熟乳では、ほぼ均等になる。
▼抗酸化物質を供給する。
▼オリゴ糖を含むタンパク質(糖質に分類)を供給し、整腸作用や腸内有用細菌を増やす。
▼野菜類が少ないと母乳のビタミン類が欠乏する。
▼母親が食事や呼吸で摂取した、有害物質(アルコール、タバコ、コーヒーなどの嗜好品、麻薬類等薬物、授乳禁忌薬剤、大気汚染物質など)を取り除き、静脈血にヘモグロビン色素と共に追い出す。
まとめ……
乳腺細胞(腺房細胞)の役割は、血液中の物質を基にして乳汁を生産し、産まれたばかりの赤ちゃんを発育させて、免疫機能を授ける生涯で最も重要や役割を担っているのです。 〔参考文献及び引用元〕
◆へるす出版 よくわかる母乳育児・第3章/母乳分泌の生理より
◆へるす出版 これでナットク母乳育児 母乳のつくられ方より
↧
October 20, 2018, 9:00 am
米Alnylam(アルナイラム)社(本部:米国マサチューセッツ州ケンブリッジ)の日本法人・Alnylam Japan株式会社(本社:東京都千代田区丸の内)は10月1日、遺伝子の突然変異による遺伝性で進行性の希少難治性疾患、トランスサイレチン型家族性(hATTR)アミロイドーシスのRNAi治療薬「patisiran(パティシラン)」について、日本で製造販売承認申請したと発表しました。
「patisiran」は2018年8月10日、世界で初めて「成人の遺伝性トランスサイレチン型(hATTR)アミロイドーシスによる多発性神経障害(=ポリニューロパチー)」治療薬として、米食品医薬品局(FDA)から「ONPATTRO」の商品名で承認を取得している。
日本国内では、希少疾病用医薬品に指定されており、Alnylam Japan株式会社は2019年半ば頃の承認取得を目指している。![遺伝性トランスサイレチン型家族性(hATTR)アミロイドーシスのRNAi治療薬patisiran]() 遺伝性トランスサイレチン型アミロイドーシスポリニューロパチー治療薬
遺伝性トランスサイレチン型アミロイドーシスポリニューロパチー治療薬
(トランスサイレチン型家族性アミロイドーシス)
RNAi(RNA interference=干渉)治療薬「patisiran(パティシラン)米国名:ONPATTRO」
診断からの生存期間中央値は4.7年。発症から平均10年で死亡に至る予後不良な疾患です。
![末梢神経に蓄積し始めたhTTRアミロイド蛋白質]() 末梢神経に張り付くように蓄積し始めたアミロイドタンパク質。
末梢神経に張り付くように蓄積し始めたアミロイドタンパク質。
トランスサイレチン(TTR)遺伝子変異はこれまで100種類以上報告されていますが、国内では約80パーセントがV30M型であり、長野県と熊本県に集積地が存在している。〔日本神経学会--遺伝性ATTRアミロイドーシスの治療の現状と今後の展望より/公益財団法人 難病医学研究財団/難病情報センター・指定難病28/全身性アミロイドーシスより〕
![日本国内の遺伝性トランスサイレチン型アミロイドーシス患者の集積地分布図]() FAP‥‥家族性アミロイドポリニューロパチー(Familial Amiloidotic Polyneuropathy)
FAP‥‥家族性アミロイドポリニューロパチー(Familial Amiloidotic Polyneuropathy)
長野県と熊本県の集積地では、20~40歳での発症が多いようですが、散発的に発生する孤発家系の患者は、全国各地から多数報告されています。
遺伝性トランスサイレチン型アミロイドーシスは、常染色体優性遺伝を示し、世界中で約5万人が罹患しており、日本国内では、未診断の患者も含めると患者数は700名と推定されています。〔ファイザー株式会社:TTR-FAPの定義・病態・疫学より〕 尚、遺伝性トランスサイレチン型アミロイドーシスポリニューロパチーは従来、家族性アミロイドポリニューロパチー(Familial Amyloid Polyneuropathy; FAP)と呼ばれていましたが、国際アミロイドーシス学会(International Society of Amyloidosis Symposium)は、hereditary-ATTR amyloidosisの病名を用いる事を推奨しており、家族型の表記が改定されており、本記事でもこれに従っています。![遺伝性ATTRアミロイドーシスの心内膜心筋生検]() 遺伝性ATTRアミロイドーシスの心臓内膜心筋生検画像。
遺伝性ATTRアミロイドーシスの心臓内膜心筋生検画像。
正常な心筋細胞の生検(上)と、
染色方法の違いによるアミロイド蛋白質の蓄積した生検画像。
TTR遺伝子の突然変異は、異常なアミロイドタンパク質を蓄積させ、難治性の末梢感覚運動神経障害、自律神経障害、または心筋症などの他の疾患が発現する。
心臓では心筋症の発症や房室ブロックによって、ペースメーカーの埋込みが必要となる。
治療法としては、[①]遺伝子変異のあるTTRの95%以上は肝臓で作られているため、発症早期に肝臓移植を行う事が、病気の進行を抑える有効な治療法です。
薬物療法では、[②]遺伝性トランスサイレチン型アミロイドーシスの疾患の経過を変更する事が出来る薬剤として唯一の承認薬:ビンダケル®カプセル20mg(ファイザー=末梢神経障害の進行抑制/1カプセル=5万7171円)がありますが、病気の原因であるアミロイドの沈着を抑える事は出来ません。
その他の病状については、[③]臓器ごとの対症療法に限られており、治療を良好に助けるための、新機序医薬品の登場が切実に望まれています。今回承認申請した「patisiran(パティシラン)/ONPATTRO™」は、2006年ノーベル生理学・医学賞を授賞した『RNA干渉(interference)の発見(発見されたのは1998年)』に基づいて、トランスサイレチン(TTR)を標的とするRNAi治療薬です。 ▲RNA干渉とは‥‥、標的遺伝子と同じ配列をもつ2本鎖のRNA(リボ核酸)を細胞内に導入すると、mRNA(メッセンジャーRNA)が分解され、遺伝子の発現が抑制される現象です。標的となるmRNAを分解させる事が出来るため、癌やエイズ、遺伝病の治療などへの応用が期待されている。![遺伝性トランスサイレチンアミロイドーシス治療薬patisiranの作用機序]() RNAi治療薬の作用機序
RNAi治療薬の作用機序
DNA中の異常な染色体情報を細胞内でRNA→→mRNAにコピーした段階で、
このmRNAを切断する事で、異常なタンパク質が作られるのを阻止する。
■輸液関連反応(IRR=薬剤投与中または投与後24時間以内に多く現れる有害事象の総称)
「patisiran」で治療された患者には、輸液関連反応(IRR)が観察されている。
制御された臨床試験では、本剤の治療患者の19%がIRRを経験した。本剤のIRRの最も一般的な症状は、潮紅、背中の痛み、吐き気、腹痛、呼吸困難、及び頭痛であった。
IRRのリスクを減らす為に、患者は本剤注入の少なくとも60分前に、副腎皮質ステロイドホルモン、パラセタモール(アセトアミノフェン)、及び抗ヒスタミン剤(H1/H2ブロッカー)で前投薬を受ける事を勧める。
輸液中の患者をIRRの徴候および症状についてモニターする。
IRRが発生した場合は、臨床的に指示されているように、輸液の減速または中断と医療管理の導入を検討すること。
輸液が中断された場合は、症状が改善した場合にのみ、注入速度を遅くして再開することを検討する。 重篤な、又は生命を脅かすIRRの場合、輸液は中止し、再開をしない。 ▲これらの有害事象(副作用)は米食品医薬品局(FDA)で承認された際の注意安全情報の直訳であり、日本国内では未承認なため、用法・用量などは明らかではありません。
あくまで参考程度にとどめて下さい。
↧
October 30, 2018, 4:48 am
ヤンセンファーマ株式会社(本社:東京都千代田区西神田)は9月20日、抗HIV薬「オデフシィ®配合錠(一般名:リルピビリン塩酸塩/テノホビル アラフェナミドフマル酸塩/エムトリシタビン)」について、『成人および小児(12歳以上で体重35kg以上)のHIV-1感染症』を効能・効果として販売を開始した。
本剤は、既に8月29日薬価収載されている。![抗HIV薬オデフシィ配合錠]() リルピビリン塩酸塩/テノホビル アラフェナミドフマル酸塩/エムトリシタビン3剤配合
リルピビリン塩酸塩/テノホビル アラフェナミドフマル酸塩/エムトリシタビン3剤配合
抗HIV薬「オデフシィ®配合錠」
「成人および小児(12歳以上で体重35kg以上)のHIV-1感染症」
ウイルスを構成する遺伝子の中には、DNAではなく、RNAを遺伝子として持っているモノがあり、この様なウイルスはRNAからDNAに遺伝情報をコピーする酵素、すなわち逆転写酵素を使って、CD4陽性Tリンパ球やマクロファージの細胞の中にウイルスを次々に大量に作る。
この様なウイルスの事をレトロウイルスと言う。他に、HTLV-1(ヒトT細胞白血病ウイルス)がある。2017年に全世界で約3,690万人がHIVに罹患していると報告されています。〔AIDS DATA:国連合同エイズ計画(UNAIDS) スイス・ジュネーブ〕
日本では、新規のHIV感染、及び後天性免疫不全症候群(AIDS)患者として年間約1,500人が報告されており、2017年の累計患者数は約2万8,750人と報告されています。
現在、全世界では先進国を中心に、新規HIV患者数は減少傾向にありますが、日本国内では新規HIV感染患者数および後天性免疫不全症候群(AIDS)の患者は、横ばいの状況が続いている。〔公益財団法人 エイズ予防財団.エイズ動向委員会報告2017年◇http://apinet.jfap.or.jp/status/2016.html〕HIV(ヒト免疫不全ウイルス)は、ウイルスやウイルスに感染した細胞を含む体液(血液、精液、腟分泌液)と濃厚に接触する事で感染します。
HIV感染症の標準治療は、複数の抗HIV治療薬を併用して、ウイルスの複製抑制、CD4陽性リンパ球数の増加、及び疾患進行の抑制を目指す、抗レトロウイルス療法(ART)です。
![HIVのライフサイクルと抗HIV薬の作用点]() HIVのライフサイクルと抗HIV薬の作用点。
HIVのライフサイクルと抗HIV薬の作用点。
日本の抗HIV治療のガイドラインでは、抗HIV治療未経験の患者に対する初回治療は、核酸系逆転写酵素阻害薬(NRTI)を2剤に、インテグラーゼ阻害薬(INSTI)、侵入阻止薬(EI)、非核酸系逆転写酵素阻害薬(NNRTI)又はプロテアーゼ阻害薬(PI)から1剤を加えた、3~4剤を組み合わせて併用する抗レトロウイルス療法(ART)が推奨されている。
〔平成29年度厚生労働行政推進調査事業費補助金 エイズ対策政策研究事業 HIV感染症及びその合併症の課題を克服する研究班. 抗HIV治療ガイドライン2018年3月〕HIV感染症の病期は、急性感染期、無症状期、AIDS(後天性免疫不全症候群)期に大別される。
急性期は発熱、発疹、リンパ節腫脹など。その後、無症状期となり、患者自身の免疫機構とHIVレトロウイルスが拮抗した状態が長期間続く。
治療を開始しなければAIDS期としてHIV増殖が続き、患者の免疫力が徐々に低下し、免疫能力が弱る事で日和見感染症(カンジダ症、クリプトコッカス症、サイトメガロウイルス症、単純ヘルペスウイルス、ニューモシスチス肺炎、トキソプラズマ脳症、ヒストプラズマ症、結核、サルモネラ菌血症など)や悪性腫瘍を引き起こす。
初感染からAIDS期に至るまでは個々の症例で異なるものの、一般的に抗HIV治療が行われない場合、AIDS発症後死亡に至るまでの期間は、約2年程度と考えられている。現在では、抗レトロウイルス療法(ART)で抗HIV薬を服薬する事で、ウイルス複製の抑制が可能となり、生命予後は著しく改善されました。
しかしながら、現在でも治療を中断すると、どんなに長期間HIVレトロウイルス増殖を抑制できていたとしても、HIV感染患者からウイルスを完全に排除する事は出来ないため、またたく間にウイルスの活性化が起こり、AIDS発症へと至る事から、生涯(服薬)治療を継続する必要があります。![HIV感染したマクロファージとCD4陽性Tリンパ球]() HIV感染した免疫系マクロファージ(CD4陽性リンパ球)
HIV感染した免疫系マクロファージ(CD4陽性リンパ球)
【製品名】:オデフシィ®配合錠
【一般名】:リルピビリン塩酸塩(既存製品名:エジュラント=NNRTI)/テノホビル アラフェナミドフマル酸塩(既存製品名:同右=NRTI)/エムトリシタビン(既存製品名:エムトリバ=NRTI)
【効能・効果】:HIV-1感染症
【用法・用量】:通常、成人および12歳以上かつ体重35kg以上の小児には、1回1錠(リルピビリンとして25mg、テノホビル アラフェナミドとして25mgおよびエムトリシタビンとして200mgを含有)を1日1回、食事中又は食直後に経口投与する。
【製造販売承認日】:2018年8月21日
【薬 価】:1錠 6043.00円
【確認事項】:B型慢性肝炎にかかっている人では、この薬の使用を中止すと B型慢性肝炎が悪化する事があります。特に進行したB型慢性肝炎の場合は、B型慢性肝炎の症状が悪化する事があります。
●飲み忘れた場合の対応
決して2回分を一度に飲まない。気がついた時に、1回分を食事中または食直後に飲んで下さい。但し、次の飲む時間が近い場合は1回飛ばして、次の時間に1回分飲んで下さい。
●本剤の特徴
「オデフシィ®配合錠」は、核酸系逆転写酵素阻害剤(NRTI)を2剤に、非核酸系逆転写酵素阻害剤(NNRTI)1剤を組み合わせた3剤配合薬です。
↧
↧
November 6, 2018, 7:58 am
厚生労働省は10月30日、鼻噴霧ステロイド薬(点鼻液)で季節性アレルギー治療薬の「フルニソリド(販売名:ロートアルガードクリアノーズ 季節性アレルギー専用)」を、要指導医薬品に指定すると告示した。安全性等に関する製造販売後調査期間は3年で、一般向けの発売時期は、これまでの所、明らかになっていない。
またこの他に、有効成分の分類で11種、24品目(下記一覧)についても同様に要指導医薬品に変更された。
要指導医薬品はスイッチOTCとも呼ばれており、一般での市販後も、安全性等に関する製造販売後調査期間が設定されており、概ね3年である。また再審査期間の指定があるものは、使用者(購入者)の身分確認が求められ、全例副作用調査の対象となっている。この期間は8年間である(主にダイレクトOTC薬)。医師による処方箋(医薬品)から要指導医薬品に移行した医薬品。【新】◆ フルニソリド(ロート製薬)⇒スギ花粉症・鼻アレルギー症状治療点鼻液=発売未定
◎販売名『ロートアルガードクリアノーズ 季節性アレルギー専用』
![シナクリン点鼻液フルニソリド]() 季節性アレルギー治療薬「シナクリン点鼻液」
季節性アレルギー治療薬「シナクリン点鼻液」
◆ クロトリマゾール(バイエル薬品/佐藤製薬)⇒イミダゾール系表在性抗真菌薬(外陰部カンジダ再発治療薬)
◎販売名『エンペシドLクリーム』〔発売済〕
◎販売名『デリーザLクリーム』〔未発売〕
◆ フェキソフェナジン塩酸塩(サノフィ)⇒非ステロイド性抗炎症・抗ヒスタミン薬(鼻炎)
◎販売名『アレグラFXジュニア』、『アレグラαジュニア』、『アレグラフレッシュジュニア』、『アレグラファインジュニア』〔FXのみ発売済〕
◆ ベポタスチン(田辺三菱製薬)⇒非ステロイド性抗炎症・抗ヒスタミン薬(皮膚掻痒)
◎販売名『タリオンR/タリオンAR』〔未発売〕
◆ ロラタジン(バイエル薬品)⇒非ステロイド性抗炎症・抗ヒスタミン薬(鼻炎)
◎販売名『クラリチンEX』、『クラリチンEX OD錠』〔発売済〕
◆ ロキソプロフェン(リードケミカル)⇒プロピオン酸系経皮吸収剤(消炎鎮痛)
◎販売名『ロキソニンSパップ/同テープ/同テープL/同ゲル』〔発売済〕
◆ チェストベリー乾燥エキス(ゼリア新薬)⇒月経前症候群治療薬
◎販売名『プレフェミン』再審査期間8年〔発売済〕
◆ トリメブチン(田辺三菱製薬)⇒消化管運動抑制薬(過敏性腸症候群治療薬)
◎販売名『セレキノンS』〔発売済〕、『セノレックスS』〔未定〕
◆ イコサペント酸エチル(持田製薬)⇒中性脂肪異常改善薬
◎販売名『エパデールT』〔発売済〕、『エパアルテ』〔処方薬中止、後未定〕
◆ ネチコナゾール塩酸塩(エスエス製薬)⇒膣カンジダ治療薬
◎販売名『エスエスカンジダクリーム』〔未発売〕、『カンジダカユミノンクリーム』〔未発売〕、『フェミディアクリーム』〔未発売〕
◆ 赤ブドウ葉乾燥エキス混合物(エスエス製薬)⇒足のむくみ改善薬
◎販売名『アンチスタックス』再審査期間8年〔発売済〕
![アンチスタックス]()
薬局での販売時に、薬剤師による対面での情報提供、及び指導が必要と義務付けられた医薬品で、インターネット販売が原則禁止とされている。医療用医薬品から一般用医薬品に移行したばかりで(スイッチOTC/*ダイレクトOTC)、市販第四相臨床試験(3年)での安全性評価が終わっていない市販薬と劇薬がこれに該当。
市販後、予期せぬ重篤な副作用が発現する可能性を否定できず、全販売量の追跡調査を必要とする。
*ダイレクトOTC薬は、医療用医薬品として承認された新規有効成分が、直接、一般用医薬品として承認されたもの。(概ね8年の再審査期間を要する)
↧
November 11, 2018, 9:22 am
杏林製薬株式会社(本社:東京都千代田区神田駿河台)と、キッセイ薬品工業株式会社(本社:長野県松本市芳野)は9月21日付けで、日本国内に於いて共同開発を進めて来た、過活動膀胱治療薬「ベオーバ®錠50mg(一般名:ビベグロン)」ついて、厚生労働省より製造販売承認を取得した。![発売準備中]() *写真はイメージです。
*写真はイメージです。
過活動膀胱治療薬「ベオーバ®錠50mg」は現在、発売準備中のため、
薬剤の写真はまだありません。
過活動膀胱(OAB)の有症状者は、加齢と共に上昇する傾向があり、国内の患者数は約810万人と推定される。〔過活動膀胱治療薬の臨床評価方法に関するガイドライン平成18年6月28日付け〕
医療機関で治療などをしていない人は、2012年の人口構成から1,040万人の患者が存在すると推定されています※。〔※過活動膀胱診療ガイドライン[第2版] 日本排尿機能学会 過活動膀胱診療ガイドライン作成委員会 編〕【過活動膀胱の定義】日本泌尿器科学会によると、過活動膀胱は、膀胱に尿が十分に溜まっていないのに、膀胱が自分の意思とは関係なく勝手に収縮するという病気、とあります。
過活動膀胱(OAB)は「排尿障害」の症状症候群に分類されており、正式には下部尿路症状(LUTS=lower urinary tract symptoms)と言われ、蓄尿症状(尿を貯めることに関連した症状)、排尿症状(尿を出すことに関連した症状)、排尿後症状(排尿した後に出現する症状)の3つに大別されます。
蓄尿症状には『頻尿・尿意切迫感・尿失禁』などの症状が含まれますが、しかしこうした症状があっても、疾患(病気)とは区別されています。疾患の対象となる症状は、蓄尿症状のある尿失禁や過活動膀胱が挙げられ、ただ単に強い尿意がある場合や、我慢できるものとは異なります。【泌尿器科受診の目安】◆せき・くしゃみ・体動などで不随意(意に反して)に尿が漏れる尿失禁は、更年期の女性に多く見られる、切迫性尿失禁と見られ、過活動膀胱の一つの形態と考えられています。
この様な症状が現れたら、早めに泌尿器科を受診すると良いでしょう。
骨盤底筋群の脆弱化や、尿道括約筋の損傷も考えられるので、理学療法を含め、早めの治療開始が症状の改善に役立ちます。「過活動膀胱診療ガイドライン」に記載されている薬物は、①抗コリン薬(膀胱収縮抑制作用)、②フラボキサート(商品名:ブラダロン)③抗うつ薬が挙げられていますが、この中で推奨グレードAは抗コリン薬のみとなっている。
その理由は、口渇等の副作用発現の他、効果不十分等により治療中止となる事もあり、近年では選択的β3アドレナリン受容体作動薬のミラベグロン(商品名:ベタニス)が、推奨グレードAに加わった。
ミラベグロン(2011年9月発売)は、抗コリン薬が無効な場合の第二選択薬として推奨されている。
また単独投与で効果不十分な場合について、2015年、米国泌尿器学会で発表された第3相試験に於いて、抗コリン薬(ソリフェナシン/国内商品名:ベシケア)で効果不十分な症例に対して、ミラベグロンを追加併用した場合の有効性と安全性が証明されている。
但し、ミラベグロン(商品名:ベタニス)には【使用上の警告】として、『生殖可能年齢への投与はできる限り避ける」とあり、これまで選択的β3アドレナリン受容体作動薬は閉経後の女性しか使えませんでした。
また妊婦・妊娠可能性の女性では禁忌となっています。
「ベオーバ®錠50mg」の有効成分であるビベグロンは、米国Merck社により創製され、日本国内では2016年3月に導入され、杏林製薬とキッセイ薬品が共同で開発した、過活動膀胱(OAB)に対する新規経口治療薬です。
膀胱のβ3アドレナリン受容体に選択的に作用し、膀胱を弛緩させる(緊張をほぐす)事で、蓄尿機能を高め、過活動膀胱(OAB)に於ける尿意切迫感、頻尿、及び切迫性尿失禁の症状を改善します。
本剤は、過活動膀胱の適応を有する選択的β3アドレナリン受容体作動薬としては、既発売のミラベグロン(商品名:ベタニス/アステラス製薬)に次ぐ2番目となります。【製品概要】
【製品名】:ベオーバ®錠50mg(Beova tablet)
【一般名】:ビベグロン(Vibegron)
【効能・効果】:過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁
【用法・用量】:通常、成人にはビベグロン50mgを1日1回食後に経口投与する
【臨床試験での副作用(臨床検査値異常を含む)】:
口腔内乾燥、便秘(各1.2%)、膀胱炎などの尿路感染、残尿量増加(各0.7%)、肝機能異常、CK(CPK)上昇(各0.3%)など。尿閉を生じる可能性あり。
◆授乳中の婦人には投与しない事が望ましいが、やむを得ず投与する場合には、授乳を中止させること。
◆妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合のみ投与すること。(妊娠中の投与に関する安全性は確立していない。)それぞれ副作用の項目が変更された。
↧
November 19, 2018, 8:55 am
武田薬品工業株式会社(本社:大阪府大阪市中央区)は11月7日、新規作用機序の潰瘍性大腸炎治療薬「エンタイビオ®点滴静注用300mg(一般名:ベドリズマブ)」を発売したと発表しました。
適応は「中等症から重症の潰瘍性大腸炎の治療及び維持療法(既存治療で効果不十分な場合に限る)」となっている。
「エンタイビオ点滴静注用300mg(一般名:ベドリズマブ)」は、ヒト化抗ヒトα4β7インテグリンモノクローナル抗体で、炎症を起こしている『腸管組織に炎症性細胞のTリンパ球の遊走を阻害』するよう設計されている。
![潰瘍性大腸炎エンタイビオ点滴静注用300mg]() ヒト化抗ヒトα4β7インテグリンモノクローナル抗体製剤
ヒト化抗ヒトα4β7インテグリンモノクローナル抗体製剤
活動期の潰瘍性大腸炎治療剤「エンタイビオⓇ点滴静注用300mg」
現在、国内の患者数は約22万人*以上と推定されています。
厚生労働省によって医療費助成制度の対象となる「指定難病」の一つに指定されています。
助成は、難病指定医によって潰瘍性大腸炎の診断となった患者のうち、一定以上の重症度、或いは軽症であっても一定以上の高額な医療を受ける必要がある患者が対象となります。
よく見られる症状は、腹痛や下痢、腹部不快感、下血や排膿などにより、著しいQOL(生活の質)の低下を余儀なくされる疾患です。
潰瘍性大腸炎の病因については明らかになっていませんが、最近の研究では、遺伝素因や環境要因に加え、腸内細菌抗原に対する異常な免疫応答など、様々な因子が関与する、多因子疾患と考えられています。
〔*潰瘍性大腸炎およびクローン病の有病者に関する全国疫学調査 調査結果報告, 厚生労働科学研究費補助金 分担研究報告書,2017〕潰瘍性大腸炎は、血管壁の隙間から浸入した炎症性細胞(白血球の一部のTリンパ球)が、大腸の粘膜組織へ浸潤し、これらの炎症性細胞の増加と停滞によって潰瘍性大腸炎に特徴的な炎症性反応が引き起こされます。
本剤は、炎症を起こしている腸管組織に、炎症性細胞の一種である“Tリンパ球の遊走を阻害する”事で、炎症を軽減するようデザインされており、細胞接着分子のMAdCAM-1*は、腸管の血管内皮に選択的に発現しており、一方α4β7インテグリンは循環血液中のある種の白血球サブセット(一部)に発現しています。〔*MAdCAM-1=Mucosal Addressin Cell Adhesion Molecule-1(粘膜アドレシン細胞接着分子-1)〕本剤は、α4β7インテグリンに特異的に結合し、α4β7インテグリンとMAdCAM-1との相互作用を阻害する事により、炎症を起こした腸管組織へのTリンパ球の遊走を抑制し、炎症を軽減します。
「エンタイビオ®(Entyvio)」は、中等症から重症の潰瘍性大腸炎、またはクローン病に対する治療薬として、現在60カ国以上の国で承認されています。
【エンタイビオ®の製品概要】
【製品名】:エンタイビオ点滴静注用300mg(Entyvio)
【一般名】:ベドリズマブ(遺伝子組換え/vedolizumab)
【効能・効果】:中等症から重症の潰瘍性大腸炎の治療及び維持療法(既存治療で効果不十分な場合に限る)
【用法・用量】:通常、成人にはベドリズマブ(遺伝子組換え)として、1回300mgを点滴静注する。初回投与後、2週目、6週目に投与し、以降8週間隔で点滴静注する。
【製造販売承認申請日】:2017年8月
【薬価基準収載日】:2018年8月29日
【薬価】:エンタイビオ点滴静注用300mg/27万4,490円
↧
November 23, 2018, 8:55 am
厚生労働省の薬事・食品衛生審議会 再生医療等製品・生物由来技術部会は11月21日、ニプロ株式会社(本社:大阪市北区)と、札幌医科大学(北海道札幌市)とが共同開発し、今年6月29日に製造販売の承認申請をしていた、「脊髄損傷の治療に用いる※自己骨髄間葉系幹細胞『ステミラック注』(治験薬識別コード:STR01)」について、※再生医療等製品として承認することを了承した。
早ければ年内にも厚生労働大臣が正式承認し、これまでリハビリ以外に有効な治療法が無かった、脊髄損傷患者への治療が行われる見通しとなった。 ※間葉系幹細胞‥‥神経や血管、軟骨や内皮細胞などに分化する能力を持った幹細胞。
▲【注】間葉系幹細胞は、多能性幹細胞とは異なり心臓や肝臓、血液や骨そのものなどの組織体への分化は確立していない。
※再生医療等製品・・・「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」第2条第9項に以下の通り定義されている。
(1)人の細胞に培養等の加工を施したものであって、
①身体の構造・機能の再建・修復・形成するもの
②疾病の治療・予防を目的として使用するもの
(2)遺伝子治療を目的として、人の細胞に導入して使用するもの「ステミラック注」は、自己骨髄間葉系幹細胞を使った、脊髄損傷に対する初の細胞治療製剤(再生医療製品)となる。
本治療には、公的医療保険が適用される見通しで、その後、来年中に販売される見通しである。![ヒト骨髄由来間葉系幹細胞]() ヒト骨髄由来間葉系幹細胞
ヒト骨髄由来間葉系幹細胞
「ステミラック注」製剤は、骨髄液の採取を「脊髄損傷受傷後31日以内を目安に実施する」とし、患者の骨髄液から採取した『間葉系幹細胞』を培養して、細胞製剤にした5千万~2億個の間葉系幹細胞を、「製品が製造され次第、可能な限り速やかに投与する」と定めた。
![脊髄損傷MRI]() 脊髄損傷患者のMRI画像
脊髄損傷患者のMRI画像
間葉系幹細胞が脊髄の損傷部に自然に集まり、炎症を抑えて神経の再生を促したり神経細胞に分化したりして、脊髄損傷に伴う神経症状や機能障害の改善が期待される、脊髄損傷に対する初の細胞治療製品となる。
![間葉系幹細胞]() ◆Copyright © 2018 読売新聞電子版より
◆Copyright © 2018 読売新聞電子版より
日本国内の治験では13例の患者によって評価され、損傷から1~2か月内に投与し、220日後の効果を評価した所、13例中12例がASIA機能障害尺度で1段階以上改善。
改善割合は、尺度B(2例)と、尺度C(5例)の患者は100%、尺度Aの患者は6例中5例が改善し83.3%の結果となった。
しかし、薬事・食品衛生審議会 再生医療等製品・生物由来技術部会は、安全性は確認できたが、治験評価症例数が少なく、有効性については推定にとどまると判断して、「条件及び期限付き承認」扱いとし、今後7年かけて、対照群を設けて比較評価を行うことにした。*但し、発表されたプレスリリースを良く読むと、既に脊髄損傷によって神経細胞の機能が停止している患者での臨床試験は行われておらず、治験症例数が少ないのも、脊髄損傷を負った直後の患者で良好な結果が得られているようです。
実際にどのような治療で、どのような患者に有効なのか、またどの程度回復できるのかは今後の症例数の積み重ねを待つしかありません。
↧
↧
December 3, 2018, 7:22 am
ファイザー株式会社(本社:東京都渋谷区代々木)は11月20日、「ALKチロシンキナーゼ阻害剤に抵抗性又は不耐容のALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌」の効能・効果で、抗悪性腫瘍剤/チロシンキナーゼ阻害剤「ローブレナ®錠25mg、同100mg(一般名:ロルラチニブ)」を発売したと発表しました。![非小細胞肺癌治療薬「ローブレナ錠25㎎、100㎎]() 抗悪性腫瘍剤/チロシンキナーゼ阻害剤「ローブレナ®錠25mg、同100mg」
抗悪性腫瘍剤/チロシンキナーゼ阻害剤「ローブレナ®錠25mg、同100mg」
(一般名:ロルラチニブ)
ALKチロシンキナーゼ阻害剤に抵抗性又は不耐容の
<第3世代ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌適応>
一方で、遺伝子の薬剤耐性変異により、2016年5月に発売された「ジカディア(セリチニブ)」のように、当初は「ザーコリ®(クリゾチニブ)」に抵抗性又は不耐容のALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌の適応で承認されたものもあります。
その後、2017年9月に「ジカディア(セリチニブ)」は、一次治療への適応拡大の承認を取得しました。![非小細胞肺がんの遺伝子変異の種類]() 非小細胞肺がんの遺伝子変異の主な種類。
非小細胞肺がんの遺伝子変異の主な種類。
◆ドライバー遺伝子とは‥‥がん遺伝子・がん抑制遺伝子と言った、がんの発生・進展に於いて直接的に重要な役割を果たす遺伝子の事で、非小細胞肺がんで同定された遺伝子の数は、およそ18種(複合パターン含む)。
その中で最も多いのがEGFR遺伝子変異(23%)。
その後順に‥‥、BRAF遺伝子変異(4%)、ALK融合遺伝子変異(3%)、RET融合遺伝子変異(3%)、PIK3CA遺伝子変異(3%)、METエクソン14スキッピング変異(3%)、ROS1融合遺伝子変異(2%)などが2%以上となっている。その中で、ALK融合遺伝子変異を標的としたALKチロシンキナーゼ阻害剤は、2012年に初めて登場した、新しい薬剤と言う事が出来ます。
本来は離れて存在するEML4(微小管結合タンパク質)遺伝子とALK(未分化リンパ腫キナーゼ)遺伝子が、逆位転座して融合。→すると、この融合遺伝子から産生されるEML4-ALK融合蛋白が、内在するチロシンキナーゼ(リン酸化する酵素の総称)を恒常的に活性化することにより、強力な癌化能を有する様になる。
![2番染色体のEML4-ALK融合遺伝子]() 第2染色体で逆位転座融合したEML4-ALK融合遺伝子変異。
第2染色体で逆位転座融合したEML4-ALK融合遺伝子変異。
第1世代のALK阻害薬「ザーコリ®(クリゾチニブ)」に次ぐ、第2世代のALK阻害薬「アレセンサ(アレクチニブ)」と「ジカディア(セリチニブ)」が増え、複数のALK阻害薬を使いこなす事により、ALK融合遺伝子陽性の非小細胞肺癌患者の予後の更なる改善が期待できるようになりました。
〔日本内科学会雑誌106巻6号・進行・再発肺癌の最新治療2017より〕
しかしながら、多くの薬剤で、既存薬で効果が得られなくなると言う、“薬剤耐性”が常に大きな壁として、治療上の課題となっていました。
これらの薬剤をどのように使い分けるかと言う課題(シークエンス=治療の順序)と、第1世代や第2世代ALK阻害薬に耐性が出来た場合の、確立された治療が無く、新たな選択肢の薬剤の登場が待ち望まれていました。![非小細胞肺癌_ALK阻害薬の治療シークエンス]() ALK陽性非小細胞肺癌におけるALK阻害薬の治療シークエンス
ALK陽性非小細胞肺癌におけるALK阻害薬の治療シークエンス
その他の特徴として、七番目に多い「ROS1融合遺伝子変異」にも高い活性を示す事から、「ローブレナ®錠」は第三世代と称され、ALK融合遺伝子とROS1融合遺伝子の染色体再構成を有する『ALK/ROS1チロシンキナーゼ阻害剤』でもあります。
![第6番染色体のROS1]() ROS1は第6番染色体にあり、ROS1融合遺伝子変異(キナーゼ)は、
ROS1は第6番染色体にあり、ROS1融合遺伝子変異(キナーゼ)は、
ROS1のエクソン番号E32,E34,E35のいずれかの部分が融合パートナーと結合する。
また、非小細胞肺癌(NSCLC)患者の約75%が、転移後、又は進行後に肺がんと診断されますが、その時点での5年生存率は、僅か5%です(何らの治療もしない場合)。
病期Ⅳ(ステージ4)の肺がんで、遠隔転移を起こしやすい臓器としては肺、脳、骨、肝臓、副腎などが代表的ですが、「ローブレナ®錠」の有効成分である『ロルラチニブ』は、他のALK阻害剤に抵抗性を示す変異腫瘍に対しても効果を発揮し、更に、脳転移の病巣にも抗腫瘍効果があるよう、【血液脳関門】を通過できるように設計されました。
臨床試験に於いて、既存のALK阻害剤に抵抗性、又は不耐容のALK陽性非小細胞肺癌(NSCLC)に対する臨床的に意義のある抗腫瘍効果と、忍容性が示されています。
「ローブレナ®錠」は、2017年10月に導入された、「医薬品の条件付き早期承認制度」の適用を受け、優先審査の対象として、約8カ月間の審査期間を経て、本年9月21日、世界に先駆けて日本での承認を取得。
また米国では、本年11月2日に米国食品医薬品局(FDA)より画期的治療薬(ブレークスルー・セラピー)、及び優先審査に指定され、承認を取得しています。 *尚、オプジーボやキイトルーダ、テセントリクなどとの違いは、癌細胞の免疫機能を阻害する事で、免疫T細胞が癌細胞への攻撃を活性化させる薬剤であるのに対して、ALK阻害剤などは、遺伝子の染色体異常による活性化を阻害する薬剤です。【ローブレナ®の製品概要】
【製品名】:ローブレナ®錠25mg/100mg(LORBRENA® Tablets 25mg/100mg)
【一般名】:ロルラチニブ(Lorlatinib)
【効能・効果】:ALKチロシンキナーゼ阻害剤に抵抗性又は不耐容のALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌
【用法・用量】:通常、成人にはロルラチニブとして1日1回100mgを経口投与する。尚、患者の状態により適宜減量する。
【製造販売承認取得日】:2018年9月21日
【薬価収載日/発売日】:2018年11月20日
【薬価】:25mg=7,216.40円/100mg=25,961.00円
↧
December 11, 2018, 8:02 am
厚生労働省の薬事・食品衛生審議会 医薬品第一部会は12月3日、小野薬品工業株式会社(本社:大阪府大阪市中央区久太郎町)が、本年4月26日に「褐色細胞腫のカテコールアミン分泌過剰状態の改善及び諸症状の改善」の予定効能・効果適応で承認申請していた、『チロシン水酸化酵素阻害剤「デムサー®カプセル250mg(一般名:メチロシン)」(開発コード/ONO-5371)』について、国内に於ける製造販売承認を了承した。
「デムサー®カプセル250mg(一般名:メチロシン)」は、厚生労働省の「医療上の必要性の高い未承認薬・適応外薬検討会議」からの開発公募品目で、開発企業の募集が行われた“希少疾病用医薬品(褐色細胞腫に於けるカテコールアミン分泌過剰状態の改善、並びにそれに伴う諸症状の改善)”に指定されています。![褐色細胞腫治療剤デムサーカプセル250mg]() 褐色細胞腫のカテコールアミン分泌過剰状態の改善、
褐色細胞腫のカテコールアミン分泌過剰状態の改善、
並びにそれに伴う諸症状の改善
チロシン水酸化酵素阻害剤「デムサー®(Demser®)カプセル250mg」
(一般名:メチロシン/Metyrosine)
![褐色細胞腫の発生は副腎]() 褐色細胞腫は副腎から。
褐色細胞腫は副腎から。
褐色細胞腫の多くは良性腫瘍(約90%)で、手術による摘出で治癒しますが、残り約10%(290~310名)の悪性褐色細胞腫では、局所浸潤や骨、肝臓に遠隔転移を伴い、手術適応にならない場合が多く、放射線療法、化学療法による長期的な治療が必要となります。
カテコールアミン※の分泌は、一般的には、持続性又は発作性の高血圧を引き起こします。
褐色細胞腫の患者は、高血圧の危機(収縮期血圧が180mmHgを超え、拡張期圧が120mmHgを超える急性血圧上昇)を発症するリスクが高いのです。
〔※カテコールアミンとは――。神経ホルモンの一種で、神経細胞と他の細胞との間の信号伝達に用いられる化学物質で、ドーパミン・ノルアドレナリン・アドレナリンなど〕
![褐色細胞腫のMIBGスキャン画像]() 褐色細胞腫のMIBGスキャン画像
褐色細胞腫のMIBGスキャン画像
MIBG(メタヨードベンジルグアニジン)シンチグラフィスキャン
高血圧性脳症(急性のせん妄(=意識障害)、嗜眠(しみん)、混乱、重度の頭痛など)、肺水腫、心筋虚血、急性腎不全などの重篤な症例(=高血圧の緊急事態)が末期臓器障害と関連している可能性があるものの、褐色細胞腫を有する高血圧症に適応を有する薬剤は、8種ほど出ていますが(交感神経遮断薬=α遮断薬、β遮断薬)、関連する薬剤は、原因が分からない本態性高血圧症の適応を含んでいるため、これら従来の降圧療法には殆ど反応しない場合もあります。しかしながら、慢性的にカテコールアミンの過剰な分泌が持続する事で、心不全や致死性不整脈などの、心血管関連事象の発症リスクが高まるとされている。 〔引用抜粋元:©2017 Valeant Pharmaceuticals North America LLC。→http://www.demser.com/ 〕![レギチーン注射液5mg]() 良性腫瘍の手術の際に利用される血圧調整剤。
良性腫瘍の手術の際に利用される血圧調整剤。
一時、製造が中止された、唯一の褐色細胞腫手術前、手術中適応製剤。
そのため、交感神経遮断薬(αβ遮断薬=高血圧症薬)などでは症状が十分にコントロール出来ない患者に対して、症状改善の効果が期待される薬剤です。
国内には、同様の作用機序の承認薬はありません。尚、承認申請時の用法・用量は、成人、12歳以上の小児には、1日500mgから経口投与する、となっている。
2018年9月現在、米国のみで承認されており、日本は世界で2番目となる。
↧
December 17, 2018, 7:08 am
アッヴィ合同会社(本社:東京都港区三田3丁目)は11月20日、再発/難治性の慢性リンパ性白血病(CLL)治療薬として開発した「ベネトクラクス(一般名:venetoclax)」について、日本での製造販売承認を申請したと発表しました。![慢性リンパ性白血病治療薬ベネトクラクス(ベンクレクスタ)]() 再発/難治性の慢性リンパ性白血病(CLL)治療薬
再発/難治性の慢性リンパ性白血病(CLL)治療薬
<経口BCL-2阻害薬>
「ベネトクラクス(一般名:venetoclax)」
米国販売名:venetoclax tablets(ベネトクラクス錠)
(米国FDA承認名:ベンクレクスタ®/VENCLEXTA_™)
国内の診断時年齢中央値は60~70歳以上、全体の4分の3以上の患者が50歳以上の中高年で、若年層や30歳未満の人には殆ど見られず、小児には見られません。
日本での発症率は、年間10万人に0.3人です。患者数は慢性リンパ性白血病が約1000人、類似の小リンパ球性リンパ腫が約1600人と推定されています。
[国立がん研究センター がん情報サービス 2018年10月]
[MSDマニュアル-家庭版、慢性リンパ性白血病-原因、症状、診断、および治療についてより]
一方で米国に於いては、毎年新たに診断される患者は、20,000人を超えています。
[米国癌学会 (2015). Chronic Lymphocytic Leukemia (CLL). http://www.cancer.org/acs/groups/cid/documents/webcontent/003111-pdf.pdf]
米国や欧州では、最も多く見られる白血病が、慢性リンパ性白血病です。日本や東南アジアでは希少疾患である為、慢性リンパ性白血病の発症は遺伝がその一因となっている事を示しています。【症状】
初期の慢性リンパ性白血病(CLL)では一般に症状が見られず、白血球数の増加から診断されます。
【診断】
•血液検査 •骨髄検査
【治療選択】
慢性リンパ性白血病は、完全に治癒する事は難しい疾患ですが、寛解に導く事で、長期生存が可能です。しかしながら、体力や免疫力の低下による再発の不安を常に抱えている事になります。
また中・高齢者が多い事から、一部(若年者)を除いては症状緩和や病状のコントロールを目的とした治療となります。
病状の進行がゆっくりのため、病期分類0 期、Ⅰ期、Ⅱ期では、慎重な経過観察を行います。
病期Ⅲ、Ⅳ期になると、リンパ節腫脹や肝臓・脾臓(ひぞう)の腫大、貧血や血小板減少などの症状が見られるようになり、治療の開始基準となります。慢性リンパ性白血病の病期分類![慢性リンパ性白血病の病期分類]()
治療は化学療法が中心で、抗がん剤や分子標的薬を単剤で使用するか、或いは多剤併用療法を行います。
第17番染色体短腕(17p-13-TP53)の欠失があったり、治療効果がなく予後不良と考えられる場合には、造血幹細胞移植が検討される。【初発一次治療(標準治療)】
(1)FC療法(フルダラビン+シクロホスファミド)
(2)FCR療法(フルダラビン+シクロホスファミド+リツキシマブ)
(3)BR療法(ベンダムスチン+リツキシマブ)
◆フルダラビン…プリン代謝拮抗薬、◆シクロホスファミド…アルキル化薬、◆リツキシマブ…分子標的薬/抗CD20モノクローナル抗体、◆ベンダムスチン(2016年)…アルキル化薬
【再発二次治療】
(1)イブルチニブ(ブルトン型チロシンキナーゼ(BTK)阻害薬:2017年)
(2)アレムツズマブ(抗CD52モノクローナル抗体)
(3)オファツムマブ(抗CD20モノクローナル抗体)
[参考資料:日本血液学会 造血器腫瘍診療ガイドライン2013]
[参考:日経メディカル Online 新規治療薬の開発で治療成績の改善が期待される慢性リンパ性白血病]
![慢性リンパ性白血病の染色体17p欠失異常]() 染色体17p欠失の症例は
染色体17p欠失の症例は
変異癌細胞の増殖抑制遺伝子が失いため、
治療抵抗性で予後不良である。
慢性リンパ性白血病では、治療によってがん細胞が正常な細胞の基準を下まわった場合に寛解として、治療効果があったと見て、経過観察になります。
しかし特に、染色体17p欠失やTp53遺伝子異常のある場合、再発や化学療法に対する治療抵抗性(難治性)が発現し、このような再発/難治性の慢性リンパ性白血病には有効な治療法が確立されていません。「ベネトクラクス(venetoclax tablets)」は、BCL-2(抗アポトーシス蛋白)と呼ばれる体内の特定タンパク質を標的とする経口BCL-2阻害剤で、癌細胞で失われてしまったアポトーシス(腫瘍細胞の自滅死)という、癌細胞の自然死、又は自己破壊の過程を回復させ、癌細胞の自死を復活させる作用がある。
【用語説明】
◆BIMやBAXはBCL-2族タンパク質であり、通常はBAD、BID、BAXおよびBIMは細胞質に存在しますが、アポトーシス促進タンパク質の活性化によるシグナルを受け取ると、細胞死のためにミトコンドリアへと移動し、そこでシトクロムcの放出を促進。結果として癌細胞をアポトーシスへ導く。
本剤が承認された場合、再発/難治性の慢性リンパ性白血病(CLL)患者に対して、従来の殺細胞性の化学療法を含まない新たな治療選択肢が可能となります。
現在も「ベネトクラクス」と他剤との併用療法を比較する、多施設共同非盲検無作為化第3相試験が進行中で、治療歴のない患者を対象に、併用療法の有効性及び安全性が検討されている。[Venclexta (venetoclax) [Package Insert]. North Chicago, Ill.: AbbVie Inc.]「ベネトクラクス(一般名:venetoclax)」は、染色体17p欠失で尚且つ、1つ以上のレジメン治療歴のある慢性リンパ性白血病に対する単剤療法として、2016年4月に米国食品医薬品局(FDA)にて承認され、現在、50カ国以上で発売されています。
また、2018年6月には、染色体17p欠失の有無を問わず、1つ以上のレジメン治療歴がある慢性リンパ性白血病(CLL)や小リンパ球性リンパ腫(SLL)に対する治療薬として、リツキシマブ(抗CD20モノクローナル抗体)との併用療法、また単剤療法が認められています。[アッヴィ合同会社プレスリリース、2018年11月20日]
↧