免疫チェックポイント阻害薬
840mg製剤のみ追加承認
改変型抗PD-L1モノクローナル抗体「テセントリク®(TECENTRIQ®)」
新適応「PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌」
また、大鵬薬品工業株式会社(本社:東京都千代田区神田錦町)は、「テセントリク®」の乳癌への適応拡大を受けた形で、9月20日、既に2010年9月に発売している抗悪性腫瘍剤「アブラキサン®(Abraxane®)点滴静注用100mg(一般名:パクリタキセル注射剤(Paclitaxel/アルブミン懸濁型)」について、乳癌に対する新たな用法・用量として、「アテゾリズマブ(遺伝子組換え)」との併用に於ける毎週投与法の承認を取得したと発表しました。

日本人女性に於ける乳がんの年間罹患者数は86,500人(2018年予測値)、また死亡者数は14,800人(2018年予測値)と推計されています。
トリプルネガティブ乳がんは、全乳癌の約15%を占め、他のタイプの乳がんに比べ、50歳未満の女性に多い事が特徴です。
〔日本乳癌学会 編. 患者さんのための乳がん診療ガイドライン 2016年版. 金原出版, p126, 2016.〕
〔日本乳癌学会 編. 乳癌診療ガイドライン ②疫学・診断編 2018年版. 金原出版, p240, 2018.〕
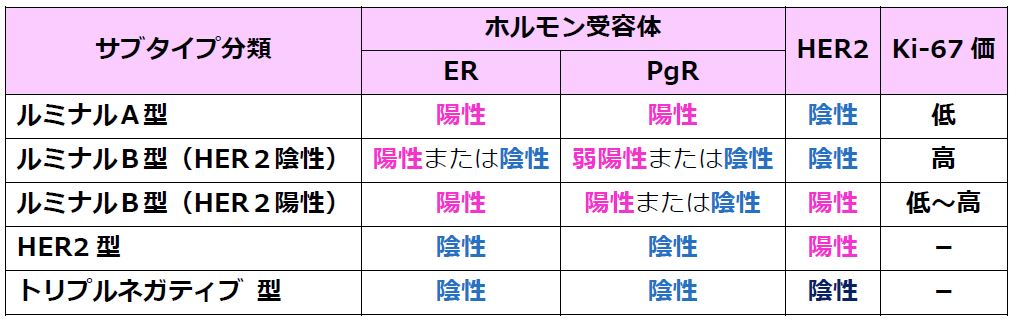
〔MSD株式会社・MSD製薬/乳がんのサブタイプ分類より〕
トリプルネガティブ乳がん(転移性乳がん)は、ホルモン受容体(エストロゲン受容体、及びプロゲステロン受容体)の発現や、ヒト上皮成長因子受容体2(HER2)の過剰発現を伴わない悪性腫瘍と定義され、他のタイプの乳がんに比べ、一般的に腫瘍増殖能が高く、生存期間が短くなると言われ、治療選択肢が極めて限られています。
「テセントリク®」は、腫瘍細胞(Target Cell)に発現するPD-L1(Programmed Death Ligand-1)と呼ばれるタンパク質を標的としたモノクローナル抗体です。
PD-L1は、T細胞の表面上に見られる“PD-1”、“B7.1(T細胞活性化共刺激分子)”の双方と結合し、T細胞の働きを阻害しています。
「テセントリク」は、この結合を阻害する事により、免疫細胞であるT細胞が活性化され、腫瘍細胞を効率的に検出し攻撃します。
「テセントリク®点滴静注(TECENTRIQ®)」は、2018年4月に「切除不能な進行・再発の非小細胞肺癌」を効能・効果として販売を開始した、非小細胞肺がん(NSCLC)の適応を持つ国内初の抗PD-L1抗体です。
2018年12月には「化学療法未治療の扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌」の追加適応を取得、更に今年(2019年)8月に「進展型小細胞肺癌」に対する効能・効果、用法・用量の追加について承認を取得している。
今回の追加承認によって、免疫チェックポイント阻害薬として国内で初めて、トリプルネガティブ乳がん(転移性乳がん)に対する治療薬となった。
【追加承認の製品概要 ※下線部が新承認項目】
【販売名】:テセントリク®点滴静注840mg、テセントリク®点滴静注1200mg
【一般名】:アテゾリズマブ(遺伝子組換え)
【効能・効果】:
<テセントリク点滴静注840mgの場合>
•PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌
<テセントリク点滴静注1200 mgの場合>
•切除不能な進行・再発の非小細胞肺癌
•進展型小細胞肺癌
【用法・用量】:
•化学療法未治療の扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌患者の場合。
カルボプラチン、パクリタキセル及びベバシズマブ(遺伝子組換え)との併用において、通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを60分かけて3週間間隔で点滴静注する。尚、初回投与の忍容性が良好であれば、2回目以降の投与時間は30分間まで短縮できる。
•化学療法既治療の切除不能な進行・再発の非小細胞肺癌患者の場合
通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200 mgを60分かけて3週間間隔で点滴静注する。なお、初回投与の忍容性が良好であれば、2回目以降の投与時間は30分間まで短縮できる。
•進展型小細胞肺癌患者の場合
カルボプラチン及びエトポシドとの併用において、通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200 mgを60分かけて3週間間隔で点滴静注する。なお、初回投与の忍容性が良好であれば、2回目以降の投与時間は30分間まで短縮できる。
•PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌患者の場合
パクリタキセル(アルブミン懸濁型)との併用において、通常、成人にはアテゾリズマブ(遺伝子組換え)として1回840mgを60分かけて2週間間隔で点滴静注する。尚、初回投与の忍容性が良好であれば、2回目以降の投与時間は30分間まで短縮できる。
【薬価】:
テセントリク®点滴静注840mg 薬価基準未収載
テセントリク®点滴静注1200mg 625,567円/1バイアル
【承認条件】:
医薬品リスク管理計画を策定の上、適切に実施すること。
――以下略――
〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓〓
【製品名/販売名】アブラキサン®点滴静注用100mg(パクリタキセル注射剤(アルブミン懸濁型))
【効能・効果】
乳癌(テセントリク®/アテゾリズマブ)との併用に限定、胃癌、非小細胞肺癌、治癒切除不能な膵癌
【用法・用量】(下線部が今回承認された内容です)
乳癌にはA法又はE法を、胃癌にはA法又はD法を、非小細胞肺癌にはB法を、治癒切除不能な膵癌にはC法を使用する。
A法:通常、成人にはパクリタキセルとして、1日1回260mg/m2(体表面積)を30分かけて点滴静注し、少なくとも20日間休薬する。これを1コースとして、投与を繰り返す。なお、患者の状態により適宜減量する。
BからD法は省略。
E法:アテゾリズマブ(遺伝子組換え)との併用において、通常、成人にはパクリタキセルとして、1日1回100 mg/m2(体表面積)を30分かけて点滴静注し、少なくとも6日間休薬する。週1回投与を3週間連続し、4週目は休薬する。これを1コースとして、投与を繰り返す。なお、患者の状態により適宜減量する。
※アテゾリズマブの効能・効果である「PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌」に限定した用法用量。































































































