October 10, 2015, 3:07 am
↧
October 16, 2015, 11:15 pm
ブログ記事内に神奈川県の相談件数でデータ不足がありましたので、修正しました。神奈川県は第2位となります。
記事引用元 : 日本経済新聞 http://www.nikkei.com/article/DGXLASDG07HAG_Y5A001C1CC0000/ そこで発表された数値をもとに、平成26年度中に、全国207か所の児童相談所が児童虐待相談として対応した件数を、多い順に都道府県別に表示してみると‥‥。 児童相談所での児童虐待相談対応件数(件/都道府県別順位) 大阪府(13738)=内訳『(大阪府7874)+(大阪市4554)+(堺市1310)』 神奈川県(10190)=内訳『神奈川県(3290)+(横浜市3617)+(川崎市1639)+(相模原市951)+(横須賀市693)』 東京都(7814) 埼玉県(6893)=内訳『(埼玉県5600)+(さいたま市1293)』 千葉県(5959)=内訳『(千葉県5173)+(千葉市786)』 愛知県(5157)=内訳『(愛知県3188)+(名古屋市1969)』 広島県(3015)=内訳『(広島県1850)+(広島市1165)』 北海道(3014)=内訳『(北海道1855)+(札幌市1159)』 兵庫県(2679)=内訳『(兵庫県1868)+(神戸市811)』 静岡県(2132)=内訳『(静岡県1184)+(静岡市511)+(浜松市437)』 京都府(2049)=内訳『(京都府1098)+(京都市951)』 福岡県(1952)=内訳『(福岡県951)+(福岡市547)+(北九州市454)』 長野県(1638) 奈良県(1567) 宮城県(1367)=内訳『(宮城県802)+(仙台市565)』 茨城県(1258) 新潟県(1227)=内訳『(新潟県814)+(新潟市413)』 三重県(1112) 滋賀県(1004) 岐阜県(996) 大分県(970) 熊本県(931)=内訳『(熊本県446)+(熊本市485)』 栃木県(931) 群馬県(920) 和歌山県(887) 青森県(834) 石川県(737)=内訳『(石川県420)+(金沢市317)』 下位10県。 山形県(343) 富山県(309) 長崎県(301) 秋田県(285) 山口県(270) 鹿児島県(247) 高知県(235) 佐賀県(190) 島根県(178) 鳥取県(82) あなたのまわりに「虐待を受けたと思われる子ども」がいたら、速やかに最寄の児童相談所、市町村、福祉事務所へ連絡(通告)して下さい。虐待を疑わせるサイン Image may be NSFW.
↧
↧
October 21, 2015, 2:06 am
武田薬品工業株式会社(本社:大阪府大阪市)は9月28日、前立腺がん及び閉経前乳がん治療剤として、「リュープリン®」(一般名:リュープロレリン酢酸塩)の24週間持続製剤である「リュープリン®PRO注射用キット22.5mg」について、厚生労働省から製造販売承認を取得したと発表しました。
▼ LHは、黄体形成ホルモン。 ◎前立腺がんの増進には、男性ホルモン(テストステロン)が関わっている。その為、前立腺がんの治療では、男性ホルモンの精巣からの分泌をブロックする必要がある。
本剤は、このようにホルモン系に指令を出す、脳下垂体・視床下部に作用して、ホルモン分泌指令をストップさせる事で、癌の増殖を抑制する方法です。 海外では、2015年5月現在、本同剤が承認されている国・地域はなく、但し、米国は日本と有効成分の含有量が異なる24週間持続型製剤(45mg含有)が承認され、またEUは、日本と有効成分含有量は同じで、添加物が異なる24週間持続型製剤が、それぞれ承認されている。 武田薬品では、製剤技術のイノベーションを重ね、米国における最初の承認時(1985年)には1日1回投与であった本剤を、1回の投与で長期間にわたって安定した血中濃度を維持することを可能にしました。現在、日本で販売されているのは、本剤の4週間持続製剤ならびに12週間持続製剤です。今回、24週間持続製剤である「リュープリン®PRO注射用キット22.5mg」の日本での承認取得は、1回の皮下注射によって長期間に渡り、安定した血中濃度を維持するため、独自のマイクロカプセル製剤技術により徐放性製剤として開発されました。 Image may be NSFW.
↧
October 28, 2015, 7:45 am
AED(自動体外式除細動器)での救命処置が行われたものの、救えなかった女子高校生の命───。
埼玉県さいたま市にある埼玉県立大宮高校で10月16日、毎年恒例の行事「強歩大会」に参加した2年生の女子生徒が、ゴール手前で倒れ、翌日に死亡した。 悲劇的な出来事は、偶然の産物ではありません。何んらかの連鎖的な出来事の結果です。 女子生徒は9月中旬にも強歩大会の練習中に倒れ、病院で診察を受けていますが、突然死を匂わせる心臓の異常はなく、低血糖、低血圧や貧血、体内ナトリウム濃度にも異常は無かったようです。 不整脈や心室頻拍や心室細動には、心臓に負荷がかかっていない場合、心電図に現れない場合があります。運動と言うストレスなどで、脳から分泌される神経伝達物質ホルモン(カテコラミン)によって発症する、心室頻拍もあります。 無論、今回の亡くなった女子生徒が、「カテコラミン感受性多型性心室頻拍(CPVT)」だったかどうかは分かりませんが、もし死因がCPVT心室細動によるものだとすれば、発症時点で血圧はほぼゼロになる為、5~15秒で意識が消失し、3~5分以内にAED(自動体外式除細動器)による救命が実行されなければ、死に至ってしまいます。 もし仮に、この女子生徒がCPVTによる不整脈が起こると分かっていれば、運動を控えるか、或いは心室細動がどこで再発した場合でも、確実に救命がなされるように植込み型除細動器(ICD)を留置する事が、突然死を回避する最も有効な手段となります。 亡くなられた女子生徒の御冥福を心よりお祈り申し上げます。
Image may be NSFW.
↧
November 2, 2015, 1:36 am
厚生労働省の薬事・食品衛生審議会 医薬品第一部会は8月28日、バイエル薬品株式会社(本社:大阪府大阪市北区)が申請していた、国指定難病「肺動脈性肺高血圧症(PAH)」治療薬の「ベンテイビス®吸入液10μg」について製造販売を承認した。
新たに発売される「ベンテイビス®吸入液10μg(一般名:イロプロスト)」は、肺血管拡張剤のプロスタグランジンI2(PGI2)誘導体製剤の一つで、新たに開発された合成プロスタサイクリン誘導体を有効成分として「肺動脈性肺高血圧症」を効能・効果とする新医薬品である。 ■ 『肺動脈性肺高血圧症(PAH)』は「難治性呼吸器疾患」に認定されている指定難病で、通常言われる動脈とは異なり、全身から心臓に帰った血液を、心臓の右心室から肺に送る血管の事を「肺動脈」と言います。 「ベンテイビス®吸入液10μg」は、プロスタグランジンI2(PGI2)誘導体と同様に血管拡張作用及び血小板凝集抑制作用を示すことで病態を改善します。
↧
↧
November 9, 2015, 7:01 am
バイエル薬品株式会社(本社:大阪府大阪市)は9月24日、経口抗凝固剤(選択的直接作用型第Ⅹa 因子阻害剤)「イグザレルト®錠(一般名:リバーロキサバン)」について、エコノミークラス症候群(急性肺動脈血栓塞栓症)に起因する、深部静脈血栓症(DVT)と肺血栓塞栓症(PE)の治療および再発抑制に対する適応追加承認を取得した。 深部静脈血栓症(DVT)と肺血栓塞栓症(PE)は総称して『静脈血栓塞栓症(VTE)』と呼ばれ、一般に「エコノミークラス症候群」 年間の死亡者数は欧州で50万人以上、米国で約30万人───。 今回、深部静脈血栓症(DVT)と肺血栓塞栓症(PE)について適応追加承認を取得した「イグザレルト®錠10mg/15mg」は、2012年4月に「非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症」の発症抑制で既に承認、販売されている薬剤です。 しかしこれまで、エコノミークラス症候群のような「静脈血栓塞栓症(VTE)」の治療には、急性期において、抗凝固剤の「ワルファリン」と抗血栓薬「へパリン」の2種が併用され、しかも個々人に必要な投与量をそれぞれ細かく用量調整したり、効果が現れるのに1週間ほどかかり、食事制限の必要があるなど、非常に煩雑でした。 「イグザレルト®錠(一般名:リバーロキサバン)」の効能・効果追加承認に関しては、海外第Ⅲ相臨床試験、及び日本国内の肺血栓塞栓症(PE)患者と深部静脈血栓症(DVT)患者のそれぞれを対象とした2つの第Ⅲ相臨床試験のデータに基づき承認された。これらによって、患者の入院期間が短縮される事も示された。 しかしエコノミークラス症候群は、予防出来る疾患あり、長時間足を曲げた姿勢で過ごす場合は、足先を動かしたり、長時間ドライブなどでは一定時間置きに休憩を取り、足伸ばしをするのが良いでしょう。 しかし同じような病態の下肢静脈瘤 では、全く症状が違います。静脈瘤 の疑いがあります。下肢静脈瘤は残念ながら完治する事はありません。 深部静脈血栓症が潜んでいるかもしれませんから・・・。
↧
November 16, 2015, 5:23 am
大鵬薬品工業株式会社(本社:東京都千代田区)は9月28日、新規抗悪性腫瘍剤「ヨンデリス®点滴静注用0.25mg/1mg」(一般名:トラベクテジン)について、「悪性軟部腫瘍」の効能・効果で、厚生労働省の独立行政法人・医薬品医療機器総合機構(PMDA)より、製造販売承認を取得した。
悪性軟部腫瘍(サルコーマ=sarcoma)は、臓器や骨組織以外の脂肪,筋肉,血管、神経、線維組織、リンパ管などに生じる腫瘍の中で、腫瘍が発生した部位だけでなく、肺、骨、リンパ節などに転移をおこす可能性を持った腫瘍を、悪性軟部腫瘍と言う。
悪性軟部腫瘍の発症頻度は、人口10万人当たり2人に発生すると言われ、国内の推定患者数約5,000人と言われる希少疾病です。 ここ数年の研究で、悪性軟部腫瘍の一部において、腫瘍特異的な染色体転座と、それに由来する融合遺伝子が存在することが分かっています。治療成績は、腫瘍の種類によって差異がありますが、悪性軟部腫瘍全体としては、手術後の5年生存率は64%。治療を開始した時点で転移が無い場合には、5年生存率は75%と言う難治性悪性腫瘍である。 腫瘍の増殖や肥大は、この正常ではない染色体転座したDNAから、腫瘍発生の異常シグナルが出続ける為、手術しても再発したり、転移したりを繰り返します。 新たに承認された「ヨンデリス点滴静注用」は、カリブ海に生息するホヤの一種『エクテインアシジア・トゥルビナータ(Ecteinascidia turbinata)』から単離された天然物で、現在は合成方法が確立されている。 そう言えば、2015年のノーベル医学生理学賞を受賞した大村智氏が、土中微生物から、寄生虫に効果のある抗生物質「エバーメクチン」を発見した事は、いまだに賞賛が鳴り止まない功績であるが、微生物や放線菌(ストレプトマイシンなど=結核)、胞子菌類(ペニシリンなど=感染症)からは過去にも、様々な抗生物質が誕生している。Image may be NSFW. Image may be NSFW.
↧
November 25, 2015, 4:33 am
性感染症の「梅毒」に感染した患者の報告が、今年は10月の時点で、既に昨年1年間の患者数を超え、現在の調査方法になった1999年以降で最多となった事が、国立感染症研究所のまとめで分かった───。
「先天梅毒」は、妊娠前期では皮膚病変,リンパ節腫脹,肝脾腫,発育不全,血液の混入した鼻汁,口周囲の割れ目,髄膜炎,脈絡膜炎,水頭症,痙攣,精神遅滞,骨軟骨炎,偽性麻痺。 昨年、「先天梅毒」と報告されたのは10例あり、死産や障害が報告された。 尚、梅毒は、梅毒血清反応が陰性であっても、梅毒に感染していないとは言い切れません。安易な検査薬ではなく、専門医による梅毒トレポネーマの細菌検査が必要です。トレポネーマが死滅するまで治療が必要になります。 Image may be NSFW.
↧
November 28, 2015, 12:41 am
発表 : 消費者庁公式プレスリリース
消費者庁は、浄水器及び磁気通水装置等の訪問販売業者である株式会社JSK(大阪市中央区久太郎町一丁目、代表取締役:金井賢治、資本金:300万円、設立:平成27年5月1日)に対し、平成27年11月25日、特定商取引法 第8条第1項の規定に基づき、平成27年11月26日から平成28年2月25日までの3か月間、訪問販売に関する業務の一部(新規勧誘、申込、受付及び契約締結)を停止するよう命じました。 ■ 認定した違反行為は以下のとおりです。 (1)株式会社JSKは、本件浄水器関連商品の販売が目的であるにも関わらず、勧誘目的及び商品の種類を明らかにしないまま、「磁気通水装置のメンテナンスに伺います。」等と告げて、過去に消費者が他社から購入した浄水器等の点検を名目に、消費者宅を訪問し、点検中又は点検後に本件浄水器関連商品の勧誘を行っていました。(勧誘目的等不明示) 消費者庁によると、株式会社JSKは、水道管の外側に取り付ける機器を「磁気通水装置」と呼び、「水の中の不純物をとる」「さびが入らないようになる」など、虚偽の効能を説明して、1台約40万円で販売。「効果はない」 と発表しており、今回販売していた製品のメーカーも不純物除去機能については謳っていないと言う。
↧
↧
November 28, 2015, 8:30 am
ファイザー株式会社(本社:東京都渋谷区)は、経口の単回治療剤としては日本初となる、「カンジダ属に起因する腟炎及び外陰腟炎」(外陰腟カンジダ症)の新効能・効果および新用法・用量で、深在性真菌症治療剤「ジフルカン®カプセル50mg/100mg」(一般名:フルコナゾール)について製造販売承認を取得した。 本剤は、この適応症の治療において、内服薬としては日本で初めての製造販売承認となる。 「ジフルカン」は1989年(平成元年)に、カンジダ属およびクリプトコッカス属による深在性真菌症および造血幹細胞移植患者における深在性真菌症の予防薬 として承認され、発売されて来ました。ストレスや免疫力低下、他の抗菌薬治療など により、しばしば発症します。 カンジダ属カンジダ・アルビカンスは、通常、私たちの消化管から大腸・直腸まで常に存在している常在菌の一種です。 「外陰腟カンジダ症」に対する治療には腟錠/腟坐剤による連日または週1回治療、及びこれらの治療方法と併用する形で、局所塗布剤が推奨されています。用法・用量カンジダ属に起因する腟炎及び外陰腟炎:通常、成人にはフルコナゾールとして150mgを1回のみ経口投与する。 ----------------------------------------------------------------------
ところで全く外陰腟カンジダ症について知らない方や、病院に行きたいが、どんな様子で診断されるか・・・? と興味を持たれた方に・・・。Image may be NSFW. Image may be NSFW.
↧
December 6, 2015, 6:30 am
武田薬品工業株式会社(本社:大阪府大阪市中央区)は11月26日、多発性硬化症治療剤「コパキソン®皮下注20mgシリンジ」(一般名:グラチラマー酢酸塩)を、日本国内で発売したと発表した。 本剤は2009年3月、厚生労働省より希少疾病用医薬品に指定され、2010年5月には厚生労働省から「医療上の必要性の高い未承認薬・適応外薬」 として、武田薬品が開発要請を受けた。
多発性硬化症(MS=Multiple Sclerosis) は、脳や脊髄に多発性の硬い病巣が見られる病気であり、中枢神経線維を覆っている髄鞘(ずいしょう)が障害を起こす自己免疫疾患で、厚生労働省の特定疾患(=神経難病)に指定されています。「コパキソン®皮下注20mgシリンジ」は、多発性硬化症の再発を予防する1日1回20mgを皮下投与注射剤です。
↧
December 13, 2015, 12:12 am
12月9日放送の、「ワールドビジネスサテライト」(テレビ東京)を見て、初めて遺伝子組み換えトウモロコシから製造された原料が、「発泡酒」や「第3のビール」に使用されている事を知った人も多かった事だろう‥‥。 しかも肝心の生産大国アメリカでは、逆に、非遺伝子組み換え食品の市場が伸びていると言う報告にも驚きだ。 所が、日本では全く逆の道を走り出していた‥‥。 ビール類のうち「発泡酒」や「第3のビール」にも、遺伝子組み換えトウモロコシ由来の原料(コーンスターチ=液糖)が使われるようになって来た。 遺伝子組み換え作物由来の液糖は、既に清涼飲料水に使われ、使用対象がビール類にも拡大した形だ。 http://mainichi.jp/articles/20151110/ddm/012/040/058000c 業界トップクラスのシェアを誇る、日本コーンスターチ(株)は、クラクソングレインと提携し、アメリカの農家から直接的に非遺伝子組み換えとうもろこしを仕入れていると発表。仕入れ価格は何んと4年前より3割安くなったという。 と、言う事は遺伝子組み換えトウモロコシで肥育された牛肉を、肉大好きアメリカ人でも避けていると言う事か・・・ではその余りはどこへ行っているのか? Image may be NSFW.
↧
December 18, 2015, 5:01 am
大塚製薬株式会社(本社:東京都千代田区)は12月7日、同社が2006年より国内で販売している抗精神病薬「エビリファイ」(一般名:アリピプラゾール)の、“小児期の自閉症における自閉性障害に伴う興奮性に対する効能・効果”で、追加申請と小児用として「エビリファイ錠1mg」の国内剤形追加販売承認申請を行ったと発表しました。 「エビリファイ」は、大塚製薬が創製し開発した「統合失調症及び双極性障害における躁症状の改善」を効能・効果とする薬剤で、ドパミンD2受容体パーシャルアゴニスト作用を有する非定型抗精神病薬 です。 自閉症は脳の発達・成熟が障害されることにより、心を通わせることが不自由になる、3歳までに発症する神経発達の病気です。小児の0.1~0.2%に見られ、10,000人に対して2~20人の有病率で、日本の患者数は約21,000人と報告されています。環境要因も発症に関係しますが、親の育て方が自閉症の発症の直接的な原因ではありません。 自閉症には様々な病態があり、それによってアスペルガー症候群、高機能自閉症、広汎性発達障害などと呼ばれていますが、症状の度合いが違うだけで、「興奮性」があれば、これらは全て『自閉症における自閉性障害』の治療薬対象となるでしょう。 「エビリファイ」の“自閉性障害に伴う興奮性”に対する効能・効果では、米国で2009年11月に、小児(6~17歳)の患者に対して本剤の承認を取得。 Image may be NSFW.
↧
↧
December 23, 2015, 12:40 am
田辺三菱製薬株式会社(本社:大阪府大阪市中央区)は12月21日、抗ヒトTNFαモノクローナル抗体製剤「レミケード®点滴静注用100」(一般名:インフリキシマブ)について、既存治療で効果不十分な難治性川崎病の急性期に対する効能・効果の追加に係る製造販売承認を取得した。
川崎病(Kawasaki disease)は、正式名称を「小児急性熱性皮膚粘膜リンパ節症候群」 と言い、1967年に日本赤十字社の小児科医・川崎富作博士が世界で初めて報告した事から、博士の名をとって病名が付けられました。 Image may be NSFW. (1)高熱が通常は5日以上続き、解熱薬があまり効かない。 川崎病で最も怖いのは、心臓の筋肉に酸素や栄養を送っている冠動脈に炎症が起こり、冠動脈瘤と言うコブが出来る事 で、乳幼児でも心筋梗塞を起こす恐れ があります。 このように川崎病の急性期では、既存治療で効果不十分な場合、後遺症が残る事から、新たな治療薬の開発が望まれていました。 今回新たに追加承認された「レミケード®点滴静注用100」は、世界初の抗ヒトTNFαモノクローナル抗体製剤で、1991年より欧米において臨床試験が開始され、1998年にクローン病治療薬として発売。 Image may be NSFW.
↧
有効な治療法の無い、国指定難病「ミトコンドリア病」の治療に効果がある新規化合物「MA-5(Mitochonic Acid-5)」による、医師主導による臨床試験(治験)を本年秋にも、東北大学病院臨床研究推進センターなど国内の4つの病院で、10人の患者を対象に半年間行う事を発表した。
「ミトコンドリア病」の原因は、細胞の中の核にDNAがあり、そのDNAが遺伝子というそれぞれ特定の情報を担っていますが、DNAにはもう一つ、ミトコンドリアの中にも別のDNAが存在する。 新規化合物「MA-5」は、東北大学大学院医学系研究科病態液性制御学分野および東北大学大学院医工学研究科分子病態医工学分野と、岡山理科大学、自治医科大学(前:神奈川県立こども医療センター)、筑波大学の共同研究グループが、尿毒症患者の血中の腎不全物質を解析する過程で、ある種の内因性インドール化合物群にATP(アデノシン三リン酸)産生亢進作用があることを見い出した。【注釈】ATP=細胞の活動に使用されるエネルギーの大部分を占める3つのリン酸基と、アデニンとリボース(アデノシン)が結合したもの。
現在「MA-5」は日本医療研究開発機構(AMED)の支援により安全性試験が行われており、安全性が確認され次第、早ければ今秋にも10人のミトコンドリア病患者での臨床治験に入る予定です。 Image may be NSFW.
↧
厚生労働省は1月8日、化学及血清療法研究所(化血研、本社:熊本市北区)に110日間(1月18日から5月6日まで)の業務停止命令を出した。
年明けまで厳しい行政処分が延びたのは、血液製剤の中で在庫不足が見込まれる3種類の製剤について、厚生労働省の「薬事・食品衛生審議会血液事業部会運営委員会」が6日、約8000本の出荷を認める案を了承し、この分は化血研への指示事項として、記録を保存することや出荷後の副作用の情報収集を徹底する事などを徹底するよう盛り込まれ、この結論を得て、1月8日、業務停止命令を発動した。 ●出荷対象血液製剤本数(出荷を認める本数7973本) 化血研の血液製剤を巡っては、約40年にわたり、承認されていない方法で製造。 今回の処分により、化血研は処分期間中、同社が製造販売する医薬品の製造・販売を停止する。 但し、患者に与える影響を鑑み、代替製品のない血液製剤8製品とその他ワクチンや抗毒素製剤など19製品は処分の対象外(業務停止除外品目)として製造・販売を継続する。 その他、除外品目以外の業務停止対象品目について厚生労働省は、業務停止期間中に医療機関から供給要請があった場合は、事前に厚生労働省の了解を得た上で出荷し、緊急の場合は必要量を出荷した後に、速やかに報告するよう求めている。 今回の血液製剤の不正製造によって、これらの製剤が献血から作られている事を考えると、非常に悪質で欺瞞としか言いようがないが、これがある種、独占企業だったと言う事から、40年以上に渡って不正が続けられてきた。内部告発だった───。 昨年5月、匿名の投書が厚生労働省に届いた。 今回の厳しい御沙汰は、過去、前例が無い程、重いお裁きとなった。 Image may be NSFW.
↧
January 15, 2016, 7:35 am
オランダ・ロッテルダムのエラスムス医療センターのティアゴ・モデスト氏らの研究グループは、2001年12月から2014年1月1日まで登録した妊婦のうち、母親の甲状腺ホルモン値が記録されていて、2006年1月31日までに子供を出産し、その後、8歳時点でADHD(注意欠如多動性障害)の検査を受けた母子3873組について、母親の甲状腺ホルモン値とADHDの発症の関係の大規模な出産群追跡調査を分析した。 【原題:Maternal Mild Thyroid Hormone Insufficiency in Early Pregnancy and Attention-Deficit/Hyperactivity Disorder Symptoms in Children ADHD(注意欠如多動性障害)の発症原因については、これまで大掛かりなコンホート(一群)での研究報告がなく、▲「砂糖を摂り過ぎた事がADHDと関係しているの?」▲「ファストフードの摂り過ぎがADHDと関係している…」▲「妊娠中の無理が子供をADHDにしてしまった……?」など、実に好き勝手な憶測が、原因として一人歩きしていました。
それでも、これから妊娠・出産を控えている女性にとっては、どう対応すればADHDを回避出来るのか、と言う最大の疑問は消えていません。 ティアゴ・モデスト氏らの研究グループは、受精卵から次第に胎児に成長し、脳が発達する段階で、胎児は母体(母親)の甲状腺ホルモンを使って成長をする事に着目。特に甲状腺ホルモンのfT4(free T4、遊離サイロキシン)を調べた。
妊娠中の甲状腺ホルモン値(TSH値、fT4値、甲状腺ペルオキシダーゼ抗体(TPOAb))は、平均妊娠週数13.6週(レンジは6.6-17.9)の時点で測定された。 妊娠期間中、甲状腺刺激ホルモン(TSH)値は変化しないままに、fT4(遊離サイロキシン)の値が軽度に低下するのを、低サイロキシン血症(甲状腺機能低下症)と呼び、CLIA法でfT4が低値(0.85ng/dL未満)の場合に該当。人種や母親の年齢、学歴、喫煙歴、世帯収入などで統計調整後も ティアゴ・モデスト氏らは今回の結果について、妊娠中の甲状腺ホルモンレベルが子供の神経発達に影響することを示唆するものとした上で、「その機序を明らかにするために、ニューロイメージングや動物実験などを行う必要がある」と提言している。 ここでは甲状腺機能低下症の原因や病態特性については省略しますが、妊娠に関与する可能性が示唆された以上、甲状腺ホルモンの検査を受け、ご自分の甲状腺ホルモン値(TSH値、fT4値、甲状腺ペルオキシダーゼ抗体(TPOAb))を把握しておく事が重要です。ティアゴ・モデスト氏らの大規模追跡調査は、オランダ人を対象としているので、これが直ぐ日本人女性にも当てはまると言うものではありません。 Image may be NSFW.
↧
↧
January 20, 2016, 3:30 am
ジェンザイム・ジャパン株式会社(本社:東京都新宿区西新宿)は12月24日、甲状腺がんの中で、発症頻度が低い希少がんの「甲状腺髄様がん」の治療薬として、抗悪性腫瘍薬「カプレルサ錠100mg(一般名:バンデタニブ)」を発売したと発表した。
甲状腺髄様がんは、甲状腺がんの内の1~2%程度の頻度で発症し、治療の第一選択肢は手術だが、進行した場合の治療の選択肢が限られ、悪性度の高い癌である。 日本での甲状腺がんの全体の総患者数は1万3000~2万9000人と推定され、甲状腺がんの病態は、全体の約92~85%を占める乳頭がん、次いで約3~10%の濾胞(ろほう)がん、1~2%程度の髄様がん、1%前後の未分化がん と、大きく4つに分類されます。甲状腺髄様がんは、乳頭がんや濾胞がんと異なり、カルシトニンというホルモンを分泌するC細胞に発症し、乳頭がんや濾胞がんはヨードを取り込む性質がある為、アイソトープ療法が可能ですが、髄様がんではこの性質が無く、放射性ヨード(ヨウ素)によるアイソトープ療法が出来ません。 今回承認された「カプレルサ錠100mg(一般名:バンデタニブ)」は、甲状腺がんの発症と病勢の進行において重要なシグナル伝達経路である、VEGFR-2チロシンキナーゼ(血管内皮増殖因子受容体2)を介した血管新生を抑制するとともに、上皮増殖因子受容体(EGFR)とRearranged during Transfection(RET)の各チロシンキナーゼを標的とする、マルチキナーゼ阻害薬である。 「カプレルサ錠100mg(一般名:バンデタニブ)」は、これまでの国内第1/2相臨床試験、及び海外での第3相臨床試験の結果、ほとんどの患者において腫瘍の縮小が認められている。 Image may be NSFW.
↧
January 26, 2016, 6:47 am
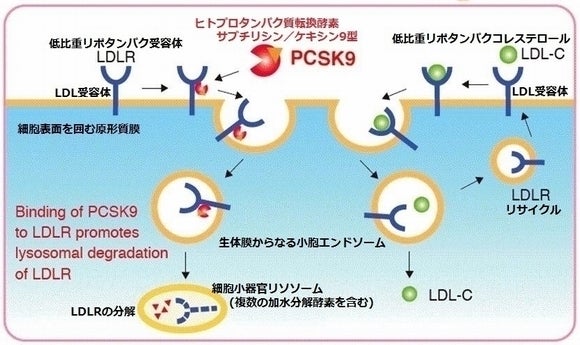
アステラス製薬株式会社(本社:東京都中央区)とアステラス・アムジェン・バイオファーマ株式会社(本社:東京都千代田区)は1月22日、小児慢性特定疾患の難病である家族性高コレステロール血症治療薬「レパーサ®皮下注(一般名:エボロクマブ(遺伝子組換え))」について、厚生労働省より製造販売承認を取得したと発表しました。 「家族性高コレステロール血症」は、生まれつき血液中の悪玉(LDL)コレステロール(-C)が異常に増えてしまう病気で、通常、LDL-Cは肝臓の細胞表面にある、LDL受容体と呼ばれる蛋白によって細胞の中に取り込まれ、壊されますが、家族性高コレステロール血症では、LDL受容体の遺伝子や、これを働かせる遺伝子に異常があり、血液中の悪玉コレステロール(LDL-C)が細胞に取り込まれず、血液の中に溜まってしまう病気です。「ホモ接合体」 と、健常人の半分程度代謝される「ヘテロ接合体」 があり、「ホモ接合体」 は父親・母親の両方にLDL受容体異常の遺伝子「ヘテロ接合体」 はどちらか一方のみに異常 これまで家族性高コレステロール血症の治療は、血清総コレステロール値(T-CHO)が生まれつき非常に高く、幼い頃から動脈硬化が進行して、小児期に心筋梗塞などの命に関わる病気を発症してしまう事から、HMG-CoA還元酵素阻害剤スタチンなどの脂質低下薬や、脂質異常症治療薬のエゼチミブ、プロブコールなどを使いますが、余り効果がなく、悪玉コレステロールを人工透析のように体外循環を用いて取り除く、「LDLアフェレシス治療」を4歳~5歳から一生続ける必要がありました。 「レパーサ®皮下注」は、国内初のヒトIgG2モノクローナル抗体で、「悪玉(LDL)」コレステロールと呼ばれる低比重リポタンパクコレステロール(LDL-C)を血中から取り除く、肝臓本来の働きを低下させる、ヒトプロタンパク質転換酵素サブチリシン/ケキシン9型(PCSK9)と結合して、低比重リポタンパク受容体(LDL-R)の分解が抑制され、肝細胞表面でのLDL-Rの再利用を可能とします。Image may be NSFW.
↧
February 1, 2016, 2:07 am
塩野義製薬株式会社(本社:大阪府大阪市中央区)とシャイアー・ジャパン社(Shire plc=本社:アイルランド、ダブリン/日本支社:東京都新宿区)は1月27日、共同で、小児期における*注意欠如・多動症(ADHD)治療薬「S-877503®」(グアンファシン塩酸塩徐放性製剤)について、日本国内での製造販売承認申請を行ったと発表しました。 「S-877503」は、2011年11月に塩野義製薬とシャイアー社との間で締結した、国内における共同開発・商業化に関するライセンス契約に基づき、小児期のADHD治療薬として共同開発が進められて来た。 新たに製造販売について承認申請が出された「S-877503」は、シナプスに存在する受容体を介してノルアドレナリン作動性神経を活性化する薬剤であり、前頭前皮質における後シナプス性α2A受容体の活性化作用により、ADHD症状を改善すると考えられている。 *注意欠如・多動症の表記について… Image may be NSFW.
↧